Wright noda adalah teknik pewarnaan yang diciptakan oleh Amerika patologi James Homer Wright pada tahun 1902, berdasarkan noda Romanowsky. Karena pewarnaan Romanowsky tidak stabil, Wright memasukkan metanol sebagai pelarut dan fiksatif.
Pewarnaan ini bersifat polikromatik, artinya menghasilkan beberapa warna tergantung pada struktur yang menyerap pewarna tersebut. Teknik pewarnaan ini telah banyak digunakan untuk melakukan penghitungan diferensial sel darah putih dan untuk mempelajari morfologi sel darah merah, trombosit, dan leukosit dalam darah tepi dan sumsum tulang.
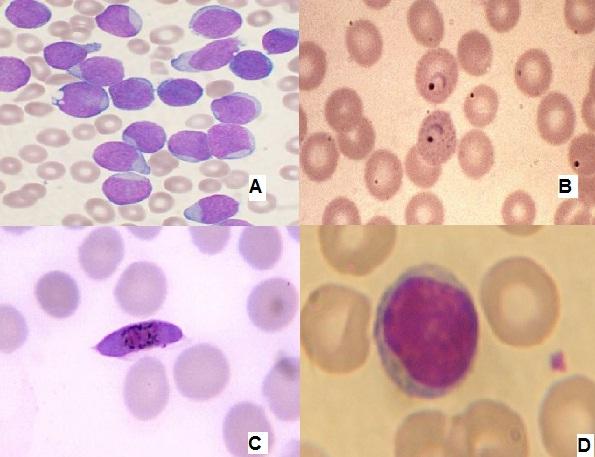
Berbagai apusan darah tepi diwarnai dengan pewarnaan Wright. A. Leukemia akut B. Plasmodium vivax di dalam eritrosit. C. Plasmodium falciparum, makrogametosit. D. Limfosit
Penerapannya sangat penting, karena kelainan dapat dilihat pada garis sel darah yang berbeda, memudahkan diagnosis penyakit seperti leukemia atau infeksi bakteri atau parasit.
Mungkin ini adalah aplikasi yang paling umum di mana teknik ini digunakan, namun bukan satu-satunya. Ini juga berguna dalam sampel selain darah dan sumsum tulang, seperti sekret hidung, lendir tinja, dahak, sampel kulit, dan lain-lain.
Indeks artikel
Alasan untuk pewarnaan Wright
Pewarnaan Wright lahir dari pewarnaan Romanowsky, yang terdiri dari larutan metil alkohol dari pewarna asam (eosin Y) dan pewarna dasar (biru metilen) dan produk oksidasinya.
Campuran pewarna yang digunakan dalam pewarnaan Wright menyebabkan efek yang dikenal sebagai Romanowsky, yaitu memberikan warna ungu yang indah pada inti leukosit dan butiran neutrofilik, sedangkan sel darah merah berwarna merah muda.
Komponen yang bertanggung jawab untuk memberikan gamut warna khas pewarnaan Wright adalah biru B dan eosin Y. Efek yang diamati akan tergantung pada pengikatan pewarna pada struktur kimia dan interaksi biru B dan eosin Y.
Struktur asam seperti asam nukleat, protein inti, dan sitoplasma imatur reaktif dari beberapa jenis sel, memfiksasi B biru (pewarnaan dasar).
Sementara struktur dasar seperti hemoglobin, butiran eosinofil tersegmentasi, antara lain struktur seluler, mengikat eosin Y (pewarna asam).
Hasil pewarnaan dapat dipengaruhi oleh berbagai faktor, seperti pH pewarna Wright, buffer dan larutan pencuci; serta waktu pewarnaan dan fiksasi.
Oleh karena itu, setiap langkah dalam persiapan reagen sangat penting dan harus dilakukan dengan memperhatikan setiap detail.
bahan
noda Wright. Untuk 100 mL diperlukan:
Timbang 0,3 g pewarna Wright, ukur 97 ml metanol dan 3 ml gliserol.
Persiapan
Tempatkan banyak noda Wright dalam mortar dan tambahkan gliserol secara bertahap sampai bubuk benar-benar larut.
Selanjutnya, metanol ditambahkan, dicampur dan dituangkan ke dalam botol amber.
Sebelum digunakan, larutan harus dikocok dengan gerakan lembut dan disaring.
Solusi penyangga
3,76 g dinatrium hidrofosfat (Na 2 HPO 4 2H 2 0) ditambah 2,1 g dihidrogen kalium fosfat (KH 2 PO 4 ) ditambahkan ke satu liter air suling .
Campur dengan baik sampai semua reagen yang dimasukkan larut. Sesuaikan pH menjadi 7,2. Tuang ke dalam toples kaca dan simpan di suhu ruang.
Bahan tambahan yang dibutuhkan untuk melakukan pewarnaan
Selain itu, bahan lain yang diperlukan untuk melakukan teknik pewarnaan, yaitu: slide objek atau penutup objek, jembatan pewarnaan, kaos dengan air atau buffer untuk mencuci, stopwatch untuk menyimpan waktu pewarnaan dan beberapa bahan blotting (kertas penyerap , kasa atau kapas).
Komponen pewarna Wright
metanol
Alkohol (metanol) berfungsi sebagai fiksatif apusan darah pada slide.
Pada dasarnya ini adalah reagen pereduksi koagulasi, dehidrasi dan fiksasi. Oleh karena itu, fungsinya adalah untuk mengentalkan protein dan membuatnya tidak larut, tetapi tanpa benar-benar mendenaturasinya.
Metanol adalah reagen fiksasi noda yang paling banyak digunakan di semua laboratorium, karena memberikan hasil yang lebih baik daripada etanol. Konsentrasi ideal adalah 99%.
peredam
Buffer ( larutan buffer) memiliki fungsi untuk mengatur atau mempertahankan pH zat warna, karena pH yang diatur hingga 7,2 sangat penting agar struktur sel dapat menyerap zat warna secara memadai.
Di sisi lain, langkah fiksasi metanol mengeringkan sel dan buffer membantu merehidrasi sel.
Eosin (Y)
Eosin memiliki afinitas untuk blok bangunan karena merupakan pewarna asam. Dua jenis eosin diketahui sangat mirip satu sama lain, sedemikian rupa sehingga salah satu dari keduanya dapat digunakan, memperoleh hasil yang sama.
Satu disebut eosin Y, eosin kuning, atau tetrabromofluorescein, dan yang lainnya disebut eosin B, eritrosin B kebiruan, atau dibromodinitrofluorescein. Namun, eosin Y adalah yang paling umum digunakan.
Sifat yang paling penting dari pewarna ini adalah polaritas negatifnya, ini membuatnya tertarik pada struktur sel yang bermuatan positif.
Biru metilen
Ini adalah pewarnaan dasar. Sifat utamanya adalah metachromasia, yaitu tidak semua struktur akan diwarnai dengan warna yang sama, itu tergantung pada komposisi kimia dari struktur yang diwarnai.
Beberapa akan berubah menjadi biru terang atau gelap dan beberapa akan berubah menjadi ungu tua atau ungu pucat.
Teknik
1-Lakukan penyebaran sampel sehingga film tipis tetap ada, baik pada kaca objek atau kaca penutup.
2-Biarkan mengering selama kurang lebih 2 jam.
3-Tempatkan apusan kering pada jembatan pewarnaan atau baki pewarnaan dengan penyebaran sampel menghadap ke atas.
4-Tutup lembaran dengan pewarna Wright setetes demi setetes sampai seluruh permukaan tertutup. Diamkan selama 5 – 8 menit.
5-Noda harus benar-benar menutupi slide, tanpa tumpah di tepinya. Jika selama waktu pewarnaan mulai menguap, tambahkan beberapa tetes tambahan.
6-Selanjutnya tambahkan jumlah yang sama dari peredam kejut, tiup sedikit sampai kilau logam yang khas muncul. Waktu 10 sampai 15 menit.
7-Cuci dengan air keran, tempatkan aliran lembut sampai seprai terlihat merah muda.
8-Dengan kain kasa yang direndam dalam alkohol, lepaskan pewarna yang menempel di bagian belakang slide.
9-Biarkan apusan mengering dengan baik sebelum menempatkan minyak imersi untuk melihatnya di bawah mikroskop.
Kegunaan
Hematologi
Ini sangat ideal untuk pewarnaan apusan darah tepi, untuk pemeriksaan apusan darah tebal, dan untuk studi sel dari sampel sumsum tulang.
Karena sifat kimia dari kombinasi pewarna ini, struktur seluler dapat dengan mudah dikenali, karena dapat membedakan berbagai jenis sel yang ada.
Pilek
Teknik ini sangat berguna untuk mengidentifikasi sel-sel sekret hidung (sel epitel, eosinofil tersegmentasi, sel polimorfonuklear) dalam diagnosis rinitis alergi.
parasitologi
Dalam pengertian ini, telah berguna untuk mempelajari Leishmania sp dalam histiosit dari jaringan seluler subkutan pada ulkus kulit. Demikian juga, digunakan untuk mengidentifikasi leukosit dalam sampel tinja (leukogram tinja).
Dalam hal ini, menarik bagi dokter untuk mengetahui apakah leukositosis yang ada pada tinja adalah polimorfonuklear atau mononuklear. Temuan dalam leukogram tinja ini akan memandu apakah itu infeksi bakteri atau virus.
Di sisi lain, parasit yang beredar dalam darah dapat ditemukan di dalam eritrosit atau bebas dalam plasma. Parasit yang dicari adalah Plasmodium spp, Trypanosoma cruzii dan filarias, dan dalam kedokteran hewan berguna untuk mencari Theileria equi dan Babesia caballi, agen penyebab bebesiosis, terutama pada kuda.
Pewarnaan Wright dan juga pewarnaan Giemsa memungkinkan untuk membedakan hemoparasit dari komponen seluler normal. Dua jenis spread dapat digunakan untuk ini:
Tersebar tipis
Darah disebarkan sebagai film tipis pada slide. Itu diwarnai dengan pewarnaan Wright, mengungkapkan karakteristik nukleus dan sitoplasma.
Tetesan tebal
Metodologi ini digunakan untuk menyelidiki keberadaan parasit dalam jumlah darah yang lebih besar.
Untuk melakukan ini, setetes besar darah ditempatkan pada slide. Sesampai di sana, itu harus didefibrilasi, membuat lingkaran semakin besar dari tengah ke luar, menggunakan tepi slide lain.
Terakhir, untuk dapat mengamati parasit pada apusan kental, eritrosit harus dilisiskan dengan air.
Infeksi saluran pernapasan
Pada tingkat pernapasan, teknik ini juga berguna, karena sel-sel yang ada dalam sampel sputum, bilasan bronkus atau bronkoalveolar, penting untuk menegakkan diagnosis.
Demikian pula, sel polimorfonuklear dan sel mononuklear dapat dibedakan di sini.
Bakteriologi
Penggunaan teknik ini dalam bakteriologi terbatas, karena tidak baik untuk pewarnaan bakteri, itulah sebabnya teknik pewarnaan khusus lainnya digunakan untuk pewarnaan mereka.
Namun, telah digunakan untuk mencari sel epitel dengan badan inklusi Chlamydia trachomatis di apusan mukosa uretra atau endoserviks, meskipun harus diakui bahwa itu bukan metode terbaik untuk ini.
Dimungkinkan juga untuk mengamati bakteri mirip spiral seperti Borrelia burgdorferi di antara sel darah merah pada pasien yang terinfeksi, serta morula atau badan inklusi Ehrlichia sp dalam sitoplasma limfosit, monosit, atau neutrofil dalam apusan darah.
Ilmu jamur
Histoplasma capsulatum adalah jamur patogen sering didiagnosis dengan pengamatan mikroskopis dari beberapa sampel jaringan, diwarnai dengan Wright ‘s noda.
Bagaimana struktur sampel darah diamati dengan pewarnaan Wright?
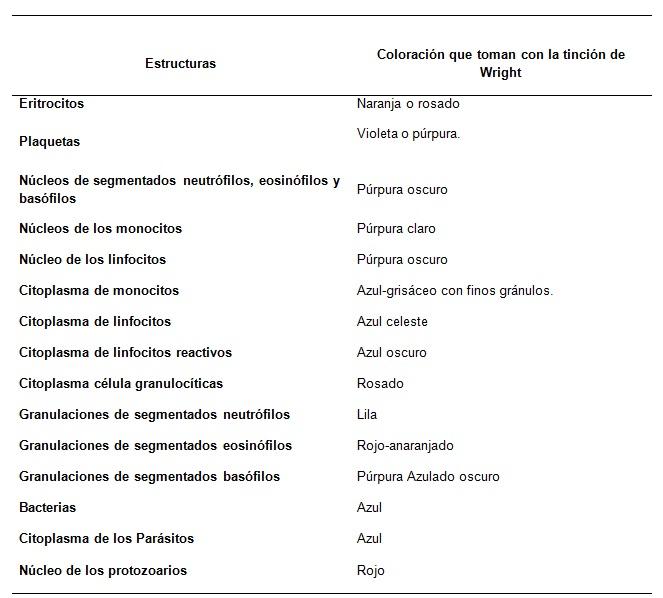
Sumber: Retamales E, Mazo V. Institut Kesehatan Masyarakat, Pemerintah Chili. Rekomendasi untuk pewarnaan apusan darah untuk membaca hemogram.
Rekomendasi untuk pewarnaan yang baik
Apusan sampel darah harus mengering secara spontan. Noda harus setipis mungkin untuk mendapatkan fiksasi pewarna yang lebih baik dan menghindari pewarnaan yang berlebihan.
Untuk noda berkualitas tinggi, disarankan untuk melakukan pewarnaan dalam waktu dua jam setelah persiapan apusan. Di sisi lain, sampel yang ideal adalah darah kapiler, tanpa antikoagulan.
Namun, jika darah vena digunakan, EDTA harus digunakan sebagai antikoagulan dan bukan heparin, karena heparin dapat merusak struktur sel.
Untuk menghindari kerusakan pewarna yang disiapkan, itu harus disimpan di tempat yang kering.
Selama proses pencucian, penggunaan air yang disesuaikan dengan pH netral sangat dianjurkan.
Akhirnya, disarankan untuk menguji metode pewarnaan yang digunakan di laboratorium dari waktu ke waktu.
Ini dilakukan dengan pewarnaan sampel atau pola yang diperluas, sebagai kontrol kualitas. Langkah ini penting, karena memastikan bahwa pewarnaan disiapkan dengan benar dan waktu pewarnaan distandarisasi dengan baik.
Jika lembar pola berwarna buruk, maka ada masalah yang harus diselesaikan.
Kesalahan umum dalam pewarnaan Wright
Pewarnaan yang sangat pucat
Noda yang sangat pucat biasanya disebabkan oleh waktu pewarnaan yang sangat singkat atau pencucian yang berlebihan. Ini diperbaiki dengan memperpanjang waktu kontak dengan pewarna atau mengurangi waktu pencucian.
Endapan pewarna
Adanya endapan noda pada apusan dapat memiliki beberapa penyebab, namun penyebab yang paling sering adalah: penggunaan noda yang tidak tersaring, pewarnaan pada jembatan pewarnaan yang tidak rata, penggunaan seprai yang kotor oleh debu atau minyak, tidak dicuci dengan baik saat pewarnaan selesai.
Noda sangat merah atau biru
Buffer bertanggung jawab atas pH pewarna. Pewarna dengan pH di bawah indikasi (asam) akan menghasilkan noda yang sangat kemerahan.
Jika pH pewarna di atas (basa) apusan yang sangat kebiruan akan diperoleh.
Mode penyimpanan
Reagen harus disimpan pada suhu kamar.
Referensi
- Gutiérrez V. Studi perbandingan antara metode pewarnaan Wright dan tes Elisa untuk diagnosis Ehrlichiosis anjing di kota San Pedro Sula, Honduras. 2008. Gelar Skripsi untuk memenuhi syarat Gelar Dokter Hewan. Universitas San Carlos Guatemala.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Noda dasar di laboratorium mikrobiologi. Penelitian Disabilitas. 2014; 3 (1): 10-18.
- “Noda Wright.” Wikipedia, Ensiklopedia Bebas . 18 Mei 2018, 12:05 UTC. 8 Des 2018, 20:37 <https://es.wikipedia.org.
- Calderon A, Cardona J, Vergara . Frekuensi Babesia spp . dalam berburu kuda, Córdoba (Kolombia). Rev. udcaactual divulg cient . 2013; 16 (2): 451-458.
- Forbes B, Sahm D, Weissfeld A (2009). Diagnosa Mikrobiologi Bailey & Scott. 12 edisi Argentina. Editorial Panamericana SA
- Retamales E, Mazo V. Institut Kesehatan Masyarakat Pemerintah Chili. Rekomendasi untuk pewarnaan apusan darah untuk membaca hemogram.

