pewarnaan Gram adalah yang paling sederhana dan paling berguna pewarnaan teknik dalam mikrobiologi diagnostik. Teknik ini diciptakan oleh dokter Denmark Hans Christian Gram pada tahun 1884, yang berhasil mengklasifikasikan bakteri sebagai Gram positif dan Gram negatif, sesuai dengan komposisi dinding selnya .
Teknik ini mengalami modifikasi tertentu oleh Hucker pada tahun 1921 untuk menstabilkan reagen dan meningkatkan kualitas pewarnaan, itulah sebabnya pewarnaan Gram juga dikenal sebagai Gram-Hucker.
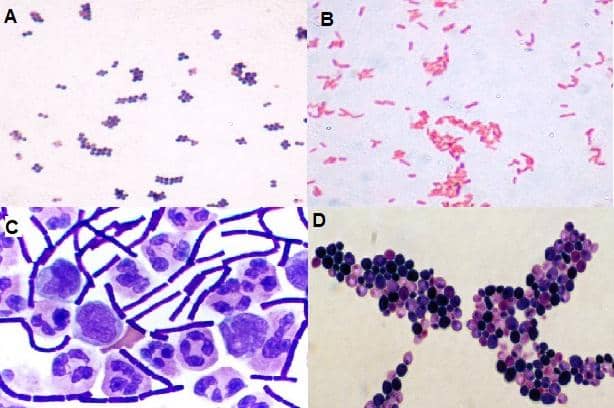
Berbagai apusan diwarnai dengan pewarnaan Gram. A. Kokus gram positif. B. Batang gram negatif. C. Basil gram positif, polimorfonuklear dan mononuklear. D. Ragi.
Dengan teknik ini juga dimungkinkan untuk mengamati bentuk mikroorganisme, yaitu apakah mereka cocci, bacilli, coccobacilli, pleomorphic, filamentous, dan lain-lain. Serta distribusinya di ruang angkasa: dalam kelompok, dalam rantai, terisolasi, berpasangan, dalam tetrad, dll.
Bila dicurigai adanya infeksi bakteri, sebagian besar sampel yang diterima harus dioleskan pada kaca objek dan diwarnai dengan pewarnaan Gram untuk pemeriksaan mikroskopis.
Laporan Gram akan memandu dokter tentang jenis mikroorganisme apa yang mungkin menjadi penyebab infeksi, sebelum mendapatkan hasil kultur yang pasti.
Dalam beberapa kasus, kehidupan pasien sangat terganggu, oleh karena itu dokter sangat membutuhkan laporan Gram untuk melakukan pengobatan empiris, sambil menunggu identifikasi mikroorganisme.
Misalnya, jika Gram mengungkapkan bahwa ada kokus Gram positif dalam cairan serebrospinal , dokter akan memandu terapi awal dengan antibiotik yang menghilangkan jenis bakteri ini, sesuai dengan protokol yang ditetapkan untuk itu.
Setelah hasil akhir tiba dengan nama mikroorganisme yang diisolasi dan antibiogramnya masing-masing, dokter akan mengevaluasi apakah akan mengubah terapi atau tidak. Keputusan ini akan dibuat sesuai dengan studi kerentanan mikroorganisme terhadap antibiotik yang diterimanya dan perkembangan pasien.
Indeks artikel
Dasar
Ini adalah teknik yang memiliki 4 langkah dasar: pewarnaan, fiksasi dengan mordan, perubahan warna dan counterstain. Oleh karena itu, teknik ini, selain mewarnai bakteri, juga memungkinkan untuk dibedakan.
Crystal violet adalah pewarna pertama yang digunakan. Ini memiliki afinitas untuk peptidoglikan dan akan menodai semua bakteri yang ada ungu, kemudian lugol ditempatkan, yang bertindak sebagai mordan, yaitu, akan menginduksi pembentukan kompleks kristal violet-iodin yang tidak larut – protein ribonuklear di dalam sel. .
Bakteri gram positif, memiliki dinding peptidoglikan yang tebal, membentuk lebih banyak kompleks (kristal violet-iodin), oleh karena itu mereka mempertahankan pewarna.
Selain itu, hal ini juga mempengaruhi bahwa dinding bakteri Gram positif mengandung lebih banyak asam tak jenuh, yang menunjukkan afinitas yang besar terhadap zat pengoksidasi (Lugol).
Sementara itu, bakteri Gram negatif memiliki lapisan peptidoglikan yang tipis, yang membuat bakteri membentuk lebih sedikit kompleks daripada bakteri Gram positif.
Kemudian datang langkah perubahan warna, di mana bakteri Gram positif dan Gram negatif berperilaku berbeda.
Bakteri gram negatif mengandung membran luar yang kaya akan lipopolisakarida yang merupakan bagian dari dinding selnya. Lemak dihancurkan melalui kontak dengan alkohol aseton, sehingga membran luar menjadi tidak stabil, melepaskan kristal ungu.
Ini adalah bagaimana kemudian counterstained dengan safranin atau fuchsin dasar, berubah menjadi merah.
Dalam kasus bakteri Gram positif, mereka menolak memudar karena pemutih bekerja dengan menutup pori-pori, mencegah kristal violet / kompleks yodium bocor keluar.
Oleh karena itu, pewarnaannya stabil dengan kristal violet, dan tidak ada ruang untuk safranin atau fuchsin. Inilah sebabnya mengapa bakteri ini berwarna biru tua atau ungu.
bahan
Pewarnaan Gram terdiri dari:
- kaca ungu
- Lugol
- alkohol aseton
- Safranin atau fuchsin dasar
Persiapan pewarna dan reagen
larutan kristal violet
Solusi untuk:
Kristal ungu —————————————— 2 gr
Etil alkohol 95% ———————————— 20cc
Solusi B:
Amonium oksalat ———————————— 0.8 gr
Air suling —————————————— 80 cc
Untuk pembuatan akhir kristal violet, larutan A harus diencerkan 1:10 dengan air suling dan dicampur dengan 4 bagian larutan B. Campuran disimpan selama 24 jam sebelum digunakan. Saring ke dalam botol pewarna kuning menggunakan kertas saring.
Jumlah yang akan digunakan setiap hari ditransfer ke botol penetes kuning.
Iodo-Lugol
Timbang dan ukur jumlah yang ditunjukkan dari masing-masing senyawa, sebagai berikut:
Kristal yodium —————————————- 1gr
Kalium iodida ————————————- 2gr
Air suling —————————————— 300 cc
Kalium iodida larut sedikit demi sedikit dalam air dan kemudian ditambahkan yodium. Solusinya dicukur ke dalam botol amber.
Jumlah yang akan digunakan setiap hari dipindahkan ke botol amber yang lebih kecil dengan penetes.
Pemutihan
95% Etil Alkohol ———————————– 50 ml
Aseton ——————————————————- 50 ml
Itu disiapkan dalam bagian yang sama. Tutup dengan baik, karena cenderung menguap.
Tempatkan dalam botol penetes.
Persiapan ini memberikan perubahan warna dalam waktu 5-10 detik dan paling direkomendasikan.
Pemula lebih suka menggunakan hanya 95% etil alkohol, di mana fading lebih lambat dari 10 sampai 30 detik.
Sedangkan yang lebih berpengalaman bisa menggunakan aseton murni, dimana perubahan warna terjadi sangat cepat dari 1 sampai 5 detik.
Kontras
Solusi Stok Safranin
Safranina ——————————————– 2.5 gr
Etil alkohol 95% ————————– 100 cc
Setelah menimbang jumlah safranin yang ditunjukkan, dilarutkan dalam 100 ml etil alkohol 95%.
Larutan safranin yang berfungsi dibuat dari larutan stok.
Untuk melakukan ini, ukur 10 cc larutan stok, tambahkan 90 cc air suling untuk membuat 100 ml.
Disarankan untuk mentransfer jumlah yang akan digunakan setiap hari ke botol amber dengan penetes.
Mikroorganisme yang pewarnaan Gram negatifnya lemah dengan pewarnaan Gram-Hucker, seperti anaerob tertentu, Legionella sp, Campylobacter sp, dan Brucella sp , dapat diwarnai dengan lebih baik menggunakan modifikasi Kopeloff dari pewarnaan Gram-Hucker, yang disebut pewarnaan Gram-Kopeloff.
Teknik ini mengubah pewarna safranin menjadi fuchsin dasar. Dengan modifikasi ini dimungkinkan untuk secara efektif mewarnai mikroorganisme tersebut.
Penyimpanan reagen
Pewarna yang disiapkan harus disimpan pada suhu kamar.
Persiapan apusan sampel yang akan diwarnai
Sampel harus mengandung setidaknya 10 5 mikroorganisme sebelum pengamatan mikroorganisme di smear adalah kemungkinan. Apusan dapat dibuat dari sampel langsung atau dari kultur dalam media padat atau cair.
Apusan harus seragam, terdistribusi dengan baik dan tidak terlalu tebal, untuk visualisasi yang lebih baik dari struktur yang ada.
-Gram sampel langsung
Gram urin yang tidak disentrifugasi
Urin dicampur dan 10 l ditempatkan pada slide. Pengamatan setidaknya satu bakteri / bidang Dip menunjukkan bahwa ada infeksi.
Ini berarti bahwa biakan akan memiliki lebih dari 100.000 CFU / ml (10 5 CFU / mL) urin pada 85% kasus.
Metode ini tidak berguna untuk jumlah koloni di bawah 100.000 CFU.
Gram CSF
CSF harus disentrifugasi, supernatan dibuang, dan pelet ditebar pada kaca objek. Cairan ini steril dalam kondisi normal; pengamatan bakteri menunjukkan infeksi.
Gram sampel pernapasan
Sputum, bilas bronkus atau bronkoalveolar Gram, meskipun mungkin terdapat berbagai mikroorganisme, akan selalu memandu diagnosis, selain berguna untuk jenis sel yang diamati.
Dalam kasus dahak, apusan harus disiapkan dengan bagian sampel yang paling purulen.
gram tinja
Tidak disarankan untuk melakukan Gram pada sampel jenis ini, karena tidak memiliki nilai diagnostik.
-Gram tanaman
Mereka dapat dilakukan dengan dua cara, satu dari kultur cair dan yang lainnya dari kultur padat.
Kultur cair
Dari biakan cair sangat sederhana; Beberapa daging panggang dari kaldu keruh diambil di bawah kompor dan ditempatkan pada slide yang bersih dan kering, membuat gerakan melingkar dari tengah menuju pinggiran, untuk mendistribusikan bahan secara merata.
Itu dibiarkan mengering secara spontan di udara. Setelah kering, bahan tersebut dipasang pada lembaran dengan panas. Untuk melakukan ini, dengan bantuan pinset, lembaran dilewatkan 3 hingga 4 kali melalui nyala pembakar Bunsen, berhati-hatilah agar tidak membakar bahan.
Lembaran dibiarkan dingin dan ditempatkan di jembatan pewarnaan.
Tanaman padat
Untuk melakukan apusan pewarnaan Gram dari kultur padat, lakukan sebagai berikut:
Sebelum memilih koloni yang akan diambil, preparat harus disiapkan, diteteskan kira-kira dua tetes larutan garam fisiologis steril.
Jika cawan kultur asli berisi beberapa jenis koloni yang berbeda, masing-masing koloni yang diisolasi akan dipilih untuk melakukan Gram. Setiap koloni akan diambil dengan platina loop untuk melarutkannya dalam larutan garam yang sebelumnya ditempatkan pada slide.
Gerakan melingkar dibuat dari pusat menuju pinggiran, untuk mendistribusikan koloni secara homogen pada slide mikroskop.
Itu dibiarkan mengering secara spontan di udara. Setelah kering, kencangkan lembaran dengan panas, seperti yang dijelaskan sebelumnya (nyalakan slide dengan korek api), berhati-hatilah agar tidak membakar bahan.
Prosedur ini harus dilakukan dengan setiap jenis koloni yang berbeda. Pada selembar kertas, urutan apa yang diamati harus dicatat, misalnya:
Koloni 1: Koloni kuning beta-hemolitik: Kokus gram positif diamati dalam kelompok
Koloni 2: Koloni berwarna krem, tanpa hemolisis: ditemukan coccobacilli Gram negatif.
Setiap slide harus diberi label untuk mengetahui apa yang kita amati.
Teknik
Teknik pewarnaan Gram sangat sederhana untuk dilakukan dan relatif murah dan tidak dapat dilewatkan di laboratorium mikrobiologi.
Ini dilakukan sebagai berikut:
- Perbaiki noda dengan panas dan letakkan di jembatan pewarnaan.
- Tutup slide sepenuhnya dengan kristal violet selama 1 menit.
- Cuci dengan air. Jangan kering
- Tutupi lembaran dengan larutan lugol, biarkan bekerja selama 1 menit. Cuci dengan air. Jangan kering.
- Pemutih selama 5-10 detik dengan pengocokan lembut dalam alkohol aseton. Atau, letakkan lembaran dalam posisi vertikal dan teteskan dekolorizer pada permukaan sampai sisa kaca violet yang tidak tertahan tersapu bersih. Tidak melebihi.
- Cuci dengan air. Jangan kering.
- Ganti slide pada jembatan pewarnaan dan tutup selama 30 detik dengan safranin (Gram-Hucker) atau 1 menit dengan fuchsin dasar (Gram-Kopeloff).
- Cuci dengan air
- Biarkan mengering secara spontan dalam posisi tegak.
Setelah kering, teteskan 1 tetes minyak imersi untuk diamati di bawah objektif 100X di mikroskop cahaya.
Kegunaan
Teknik ini memungkinkan untuk membedakan perbedaan morfotintorial sebagian besar bakteri.
Ragi juga dibedakan dengan pewarnaan ini. Mereka mengambil kristal violet, yaitu, mereka menodai Gram positif.
Di sisi lain, basil Gram-positif pembentuk spora dapat dibedakan, di mana ruang bening diamati di dalam basil, di mana endospora terbentuk, meskipun spora tidak ternoda dengan baik. Teknik lain seperti Shaeffer-Fulton digunakan untuk menodai spora.
Perlu dicatat bahwa pewarnaan ini tidak digunakan untuk mewarnai semua jenis bakteri, yaitu, ada kasus di mana pewarnaan tidak berfungsi.
Dalam hal ini, dapat disebutkan bakteri yang tidak memiliki dinding sel. Contoh: genus Mycoplasma, spheroplasts, ureaplasma, L-forms, dan protoplas.
Ini juga menodai bakteri yang sangat buruk dengan dinding yang kaya akan asam mikolat, seperti Mycobacteria, dan bakteri intraseluler seperti Chlamydias dan Rickettsia.
Ini juga tidak efektif dalam pewarnaan sebagian besar bakteri spirochetal.
Ada bakteri dari genus yang sama yang dapat dilihat dalam sampel yang sama seperti Gram positif dan Gram negatif. Ketika ini terjadi disebut pewarnaan Gram variabel, yang dapat disebabkan oleh perubahan nutrisi, suhu, pH atau konsentrasi elektrolit.
Kesalahan Umum
Perubahan warna yang berlebihan
Berlebihan dalam langkah perubahan warna dapat menyebabkan pengamatan mikroorganisme Gram negatif palsu.
Jangan menunggu waktu pengeringan yang cukup lama untuk menambahkan minyak imersi:
Kesalahan ini menyebabkan misel lemak terbentuk, sehingga sulit untuk melihat struktur yang ada. Ini terjadi ketika minyak mengikat molekul air yang ada dalam noda.
Membalikkan urutan reagen:
Kesalahan seperti ini akan menyebabkan bakteri Gram negatif tampak ungu, yaitu Gram positif palsu.
Gunakan kultur lama (padat atau cair):
Ini dapat menyebabkan bakteri Gram positif menodai Gram negatif (Gram negatif palsu). Hal ini terjadi karena pada kultur lama kemungkinan terdapat bakteri yang mati atau rusak dan pada kondisi tersebut bakteri tidak dapat mempertahankan kristal violet.
Gunakan solusi lugol yang sangat tua:
Seiring waktu lugol kehilangan sifat-sifatnya dan warnanya memudar. Jika reagen yang sudah terdegenerasi digunakan, itu tidak akan memperbaiki kristal violet dengan baik, oleh karena itu ada kemungkinan memperoleh visualisasi mikroorganisme Gram negatif palsu.
Latar belakang kebiruan
Latar belakang yang berubah warna dengan benar akan menjadi merah. Latar belakang biru menunjukkan bahwa perubahan warna tidak mencukupi.
Referensi
- Ryan KJ, Ray C. 2010. Sherris . Mikrobiologi Medis , Edisi ke-6 McGraw-Hill, New York, AS
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. (edisi ke-5). Argentina, Editorial Panamericana SA
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnosis Mikrobiologi Bailey & Scott. 12 edisi Argentina. Editorial Panamericana SA
- Casas-Rincón G. 1994. Mikologi Umum. Edisi ke-2 Universitas Pusat Venezuela, Edisi Perpustakaan. Venezuela Caracas.
- “Noda gram.” Wikipedia, Ensiklopedia Bebas . 4 Okt 2018, 23:40 UTC. 9 Des 2018, 17:11. Diambil dari es.wikipedia.org.
- González M, González N. 2011. Manual Mikrobiologi Medis. Edisi ke-2, Venezuela: Direktorat media dan publikasi Universitas Carabobo.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. Noda dasar di laboratorium mikrobiologi. Penelitian Disabilitas. 2014; 3 (1): 10-18.

