fiksasi nitrogen adalah himpunan biologis dan non – proses biologis yang menghasilkan bentuk kimia nitrogen tersedia untuk makhluk hidup. Ketersediaan nitrogen mengontrol dengan cara yang penting fungsi ekosistem dan biogeokimia global, karena nitrogen adalah faktor yang membatasi produktivitas primer bersih di ekosistem darat dan akuatik.
Dalam jaringan organisme hidup, nitrogen adalah bagian dari asam amino, unit protein struktural dan fungsional seperti enzim. Ini juga merupakan unsur kimia penting dalam konstitusi asam nukleat dan klorofil.

Selain itu, reaksi biogeokimia reduksi karbon ( fotosintesis ) dan oksidasi karbon (respirasi), terjadi melalui mediasi enzim yang mengandung nitrogen, karena mereka adalah protein.
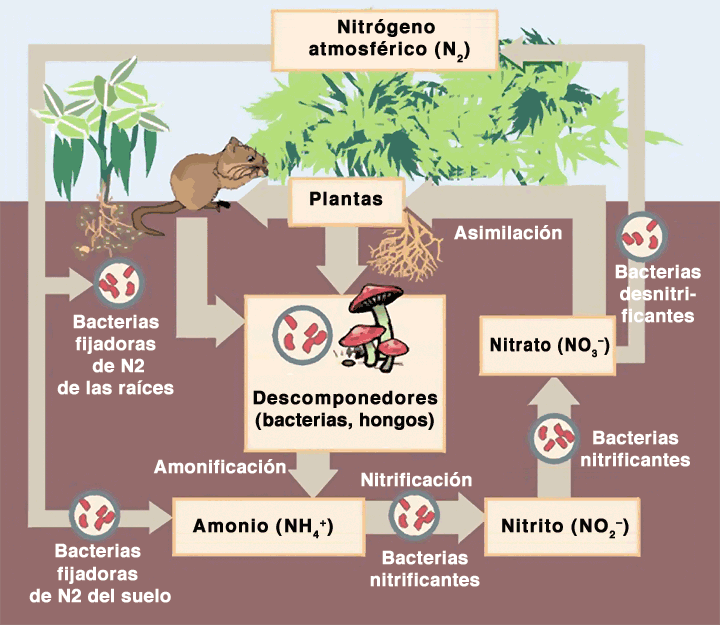
Dalam reaksi kimia siklus nitrogen biogeokimia, unsur ini mengubah bilangan oksidasinya dari nol pada N 2, menjadi 3- pada NH 3 , 3+ pada NO 2 – dan NH 4 + , dan menjadi 5+ pada NO 3 – .
Beberapa mikroorganisme memanfaatkan energi yang dihasilkan dalam reaksi reduksi oksida nitrogen ini dan menggunakannya dalam proses metabolisme mereka. Reaksi mikroba inilah yang secara kolektif mendorong siklus nitrogen global.
Bentuk kimia nitrogen yang paling melimpah di planet ini adalah nitrogen diatomik molekul gas N 2 , yang merupakan 79% dari atmosfer bumi .
Ini juga merupakan spesies kimia nitrogen yang paling tidak reaktif, praktis lembam, sangat stabil, karena ikatan rangkap tiga yang menghubungkan kedua atom. Karena alasan ini, nitrogen yang melimpah di atmosfer tidak tersedia bagi sebagian besar makhluk hidup.
Nitrogen dalam bentuk kimia yang tersedia untuk makhluk hidup diperoleh melalui “fiksasi nitrogen”. Fiksasi nitrogen dapat terjadi melalui dua cara utama: bentuk fiksasi abiotik dan bentuk fiksasi biotik.
Indeks artikel
Bentuk abiotik dari fiksasi nitrogen
badai listrik

Gambar 2. Badai listrik Sumber: pixabay.com
Petir atau “petir” yang dihasilkan selama badai listrik bukan hanya kebisingan dan cahaya; mereka adalah reaktor kimia yang kuat. Karena aksi petir, nitrogen oksida NO dan NO 2 diproduksi selama badai , yang secara umum disebut NO x .
Pelepasan listrik ini, yang diamati sebagai kilat, menghasilkan kondisi suhu tinggi (30.000 o C) dan tekanan tinggi, yang mendorong kombinasi kimia oksigen O 2 dan nitrogen N 2 dari atmosfer, menghasilkan nitrogen oksida NO x .
Mekanisme ini memiliki tingkat kontribusi yang sangat rendah terhadap tingkat total fiksasi nitrogen, tetapi ini adalah yang paling penting di antara bentuk-bentuk abiotik.
Membakar bahan bakar fosil
Ada kontribusi antropogenik untuk produksi nitrogen oksida. Kita telah mengatakan bahwa ikatan rangkap tiga yang kuat dari molekul nitrogen N 2 hanya dapat diputus dalam kondisi ekstrim.
Pembakaran bahan bakar fosil yang berasal dari minyak bumi (dalam industri dan transportasi komersial dan swasta, maritim, udara dan tanah), menghasilkan sejumlah besar NO x emisi ke atmosfer.
N 2 O yang dipancarkan dalam pembakaran bahan bakar fosil adalah gas rumah kaca yang kuat yang berkontribusi terhadap pemanasan global planet ini.
Pembakaran biomassa
Ada juga kontribusi nitrogen oksida NO x dengan membakar biomassa di daerah dengan suhu nyala tertinggi, misalnya pada kebakaran hutan, penggunaan kayu bakar untuk pemanasan dan memasak, pembakaran sampah organik dan penggunaan biomassa sebagai sumber. dari energi kalori.
Nitrogen oksida NOx yang dipancarkan ke atmosfer dengan cara antropogenik menyebabkan masalah pencemaran lingkungan yang serius, seperti kabut fotokimia di lingkungan perkotaan dan industri, dan kontribusi penting terhadap hujan asam.
Emisi nitrogen dari erosi tanah dan pelapukan batuan
Erosi tanah dan pelapukan batuan dasar yang kaya nitrogen memaparkan mineral pada unsur-unsur yang dapat melepaskan oksida nitrogen. Pelapukan batuan dasar terjadi karena paparan faktor lingkungan, yang disebabkan oleh mekanisme fisik dan kimia yang bekerja bersama.
Pergerakan tektonik secara fisik dapat mengekspos batuan kaya nitrogen ke unsur-unsurnya. Selanjutnya secara kimiawi, pengendapan hujan asam menyebabkan reaksi kimia yang melepaskan NO x, baik dari batuan jenis ini maupun dari tanah.
Ada penelitian terbaru yang menetapkan 26% dari total nitrogen yang tersedia secara hayati di planet ini untuk mekanisme erosi tanah dan pelapukan batuan ini.
Bentuk biotik fiksasi nitrogen
Beberapa mikroorganisme bakteri memiliki mekanisme yang mampu memutuskan ikatan rangkap tiga N 2 dan menghasilkan NH 3 amonia , yang dengan mudah diubah menjadi ion NH 4 + amonium yang dapat dimetabolisme .
Mikroorganisme yang hidup bebas atau bersimbiosis
Bentuk-bentuk fiksasi nitrogen oleh mikroorganisme dapat terjadi melalui organisme yang hidup bebas atau melalui organisme yang hidup bersimbiosis dengan tanaman .
Meskipun ada perbedaan morfologi dan fisiologis yang besar antara mikroorganisme pengikat nitrogen, proses fiksasi dan sistem enzim nitrogenase yang digunakan oleh semua ini sangat mirip.
Secara kuantitatif, fiksasi nitrogen biotik melalui dua mekanisme ini (kehidupan bebas dan simbiosis) adalah yang paling penting secara global.
Mekanisme untuk menjaga sistem nitrogenase tetap aktif
Mikroorganisme pengikat nitrogen memiliki mekanisme strategis untuk menjaga sistem enzimatik nitrogenase mereka tetap aktif.
Mekanisme ini termasuk perlindungan pernapasan, perlindungan kimia konformasi, penghambatan reversibel aktivitas enzim, sintesis tambahan nitrogenase alternatif dengan vanadium dan besi sebagai kofaktor, penciptaan hambatan difusi untuk oksigen, dan pemisahan spasial nitrogenase.
Beberapa memiliki mikroaerofilia, seperti bakteri dari genus quimótrofas Azospirilium, Aquaspirillum, Azotobacter, Beijerinkia, Azomonas, Derxia, Crynebacterium, Rhizobium, Agrobacterium, Thiobacillus dan gender phototrophic Gleocapsa, Anabaena, Spirulina, Nostoc, Oscilla.
Lainnya hadir anaerobiosis fakultatif, seperti genera chemotrophic: Klebsiella , Citrobacter, Erwinia, Bacillus, Propionibacterium dan phototrophs dari Rhodospirillum, Rhodopsuedomonas genera .
Fiksasi nitrogen biotik oleh mikroorganisme yang hidup bebas
Mikroorganisme pengikat nitrogen yang hidup di dalam tanah dalam bentuk bebas (asimbiosis) pada dasarnya adalah archaebacteria dan bakteri.
Ada beberapa jenis bakteri dan cyanobacteria yang dapat mengubah nitrogen atmosfer, N 2, menjadi amonia, NH 3 . Menurut reaksi kimianya:
N 2 + 8H + + 8e – +16 ATP → 2 NH 3 + H 2 +16 ADP + 16Pi
Reaksi ini memerlukan mediasi dari sistem enzim nitrogenase dan kofaktor, vitamin B 12 . Selain itu, mekanisme fiksasi nitrogen ini menghabiskan banyak energi, bersifat endotermik dan membutuhkan 226 Kkal / mol N 2 ; yaitu, ia membawa biaya metabolisme yang tinggi, itulah sebabnya ia harus digabungkan dengan sistem yang menghasilkan energi.
Energi yang dibutuhkan selama N 2 reaksi fiksasi
Energi untuk proses ini diperoleh dari ATP, yang berasal dari fosforilasi oksidatif yang digabungkan ke rantai transpor elektron (yang menggunakan oksigen sebagai akseptor elektron terakhir).
Proses reduksi molekul nitrogen menjadi amonia juga mereduksi hidrogen dalam bentuk proton H + menjadi molekul hidrogen H2 .
Banyak sistem nitrogenase telah menggabungkan sistem daur ulang hidrogen yang dimediasi oleh enzim hidrogenase. Cyanobacteria pengikat nitrogen menggabungkan fotosintesis dengan fiksasi nitrogen.
Enzim kompleks nitrogenase dan oksigen
Kompleks enzim nitrogenase memiliki dua komponen, komponen I, dinitrogenase dengan molibdenum dan besi sebagai kofaktor (yang akan kita sebut protein Mo-Fe), dan komponen II, dinitrogenase reduktase dengan besi sebagai kofaktor (protein Fe).
Elektron yang terlibat dalam reaksi disumbangkan pertama ke komponen II dan kemudian ke komponen I, di mana reduksi nitrogen terjadi.
Untuk transfer elektron dari II ke I terjadi, Fe-protein diperlukan untuk mengikat Mg-ATP di dua situs aktif. Penyatuan ini menghasilkan perubahan konformasi pada Fe-protein. Kelebihan oksigen dapat menghasilkan perubahan konformasi lain yang tidak menguntungkan pada protein Fe, karena ia membatalkan kapasitas penerimaan elektronnya.
Inilah sebabnya mengapa kompleks enzim nitrogenase sangat rentan terhadap keberadaan oksigen di atas konsentrasi yang dapat ditoleransi dan bahwa beberapa bakteri mengembangkan bentuk kehidupan mikroaerofilik atau anaerobiosis fakultatif.
Di antara bakteri pengikat nitrogen yang hidup bebas, kita dapat menyebutkan kemotrof yang termasuk dalam genus Clostridium , Desulfovibrio, Desulfotomaculum, Methanosarcina, dan fototrof dari genus Chromatium, Thiopedia, Ectothiordospira , antara lain.
Fiksasi nitrogen biotik oleh mikroorganisme yang hidup bersimbiosis dengan tanaman
Terdapat mikroorganisme pengikat nitrogen lainnya yang mampu bersimbiosis dengan tanaman, terutama dengan legum dan rerumputan, baik dalam bentuk ektosimbiosis (di mana mikroorganisme tersebut berada di luar tanaman), maupun endosimbiosis (di mana mikroorganisme tersebut hidup di dalam sel). atau di ruang antar sel tumbuhan).
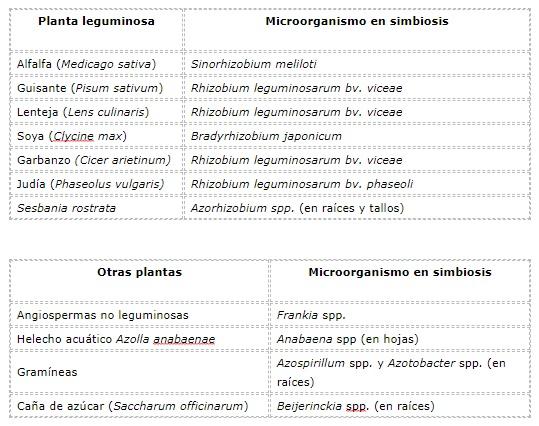
Sebagian besar nitrogen yang terfiksasi dalam ekosistem terestrial berasal dari asosiasi simbiosis bakteri dari genus Rhizobium, Bradyrhizobium, Sinorhizobium, Azorhizobium, Allorhizoium dan Mesorhizobium , dengan tanaman legum.
Ada tiga jenis simbiosis pengikat nitrogen yang menarik: rhizocenosis asosiatif, sistem dengan cyanobacteria sebagai simbion, dan endorizobiosis mutualistik.
Rhizocenosis
Dalam simbiosis seperti rhizocenosis asosiatif, tidak ada struktur khusus yang terbentuk di akar tanaman.
Contoh simbiosis jenis ini adalah antara tanaman jagung ( Zea maiz ) dan tebu ( Saccharum officinarum ) dengan Gluconacetobacter, Azoarcus , Azospirillum dan Herbaspirillum.
Dalam rhizocenosis, bakteri pengikat nitrogen menggunakan eksudat akar tanaman sebagai media nutrisi dan menjajah ruang antar sel korteks akar.
Sianobakteri simbiosis
Dalam sistem di mana cyanobacteria berpartisipasi, mikroorganisme ini telah mengembangkan mekanisme khusus untuk koeksistensi fiksasi nitrogen anoksik dan fotosintesis oksigeniknya.
Misalnya, di Gleothece dan Synechococcus , mereka berpisah sementara: mereka melakukan fotosintesis siang hari dan fiksasi nitrogen malam hari.
Dalam kasus lain, ada pemisahan spasial dari kedua proses: nitrogen difiksasi dalam kelompok sel yang berdiferensiasi (heterokista), di mana fotosintesis tidak dilakukan.
Asosiasi simbiosis pengikat nitrogen dari cyanobacteria dari genus Nostoc telah dipelajari dengan tanaman non-vaskular (antóceras), seperti pada rongga Nothocerus endiviaefolius, dengan lumut hati Gakstroemia magellanica dan Chyloscyphus obvolutus di ektosimbiosis secara terpisah, dengan lumut (membentuk lumut), dan dengan tanaman angiosperma yang lebih tinggi, misalnya dengan 65 herba abadi dari genus Gunnnera .
Misalnya, asosiasi simbiosis pengikat nitrogen dari cyanobacteria Anabaena dengan bryophyte, tanaman non-vaskular , telah diamati pada daun pakis kecil Azolla anabaenae.
Endorhizobiosis
Sebagai contoh endorhizobiosis, kita dapat menyebutkan asosiasi yang disebut actinorrhiza yang terbentuk antara Frankia dan beberapa tanaman berkayu seperti casuarina ( Casuarina cunninghamiana ) dan alder ( Alnus glutinosa ), dan asosiasi Rhizobium- legum.
Sebagian besar spesies dari famili Leguminosae membentuk asosiasi simbiosis dengan bakteri Rhizobium dan mikroorganisme ini memiliki spesialisasi evolusioner dalam mentransfer nitrogen ke tanaman.
Di akar tanaman yang terkait dengan Rhizobium, apa yang disebut nodul radikal muncul, di mana fiksasi nitrogen terjadi.
Pada legum Sesbania dan Aechynomene , bintil tambahan terbentuk pada batang.
- Sinyal kimia
Ada pertukaran sinyal kimia antara simbiosis dan inangnya. Tumbuhan telah ditemukan memancarkan jenis flavonoid tertentu yang menginduksi ekspresi gen anggukan di Rhizobium , yang menghasilkan faktor nodulasi.
Faktor nodulasi menghasilkan modifikasi pada rambut akar, pembentukan saluran infeksi dan pembelahan sel di korteks akar, yang mendorong pembentukan nodul.
Beberapa contoh simbiosis pengikat nitrogen antara tumbuhan tingkat tinggi dan mikroorganisme ditunjukkan pada tabel berikut.
Mikorizobiosis
Selain itu, di sebagian besar ekosistem, terdapat jamur mikoriza pengikat nitrogen, yang termasuk dalam filum Glomeromycota, Basidiomycota, dan Ascomycota.
Jamur mikoriza dapat hidup secara ektosimbiosis, membentuk selubung hifa di sekitar akar halus beberapa tanaman dan menyebarkan hifa tambahan ke seluruh tanah. Juga di banyak daerah tropis, tanaman inang mikoriza endosimbiosis, yang hifanya menembus sel-sel akar.
Ada kemungkinan bahwa jamur membentuk mikoriza dengan beberapa tanaman secara bersamaan, dalam hal ini hubungan timbal balik terbentuk di antara mereka; atau bahwa jamur mikoriza diparasit oleh tanaman yang tidak berfotosintesis, mikoheterotrofik, seperti tanaman dari genus Monotropa . Juga, beberapa jamur dapat menjalin simbiosis dengan satu tanaman secara bersamaan.
Referensi
- Inomura, K. , Bragg, J. dan Mengikuti, M. (2017). Sebuah analisis kuantitatif biaya langsung dan tidak langsung fiksasi nitrogen. Jurnal ISME. 11:166-175.
- Masson-Bovin, C. dan Sachs, J. (2018). Fiksasi nitrogen simbiosis oleh rhizobia – akar dari kisah sukses. Biologi Tumbuhan. 44: 7-15. doi: 10.1016 / j.pbi.2017.12.001
- Menge, DNL, Levin, SA dan Hedin, LO (2009). Strategi fiksasi nitrogen fakultatif versus wajib dan konsekuensi ekosistemnya. Naturalis Amerika. 174 (4) doi: 10.1086 / 605377
- Newton, KAMI (2000). Fiksasi nitrogen dalam perspektif. Dalam: Pedrosa, Editor FO. Fiksasi nitrogen dari molekul ke produktivitas tanaman. Belanda: Penerbit Akademik Kluwer. 3-8.
- Pankieviz; VCS, lakukan Amaral; FP, Santos, KDN, Agtuca, B., Xu, Y., Schultes, MJ (2015). Fiksasi nitrogen biologis yang kuat dalam caral asosiasi bakteri-rumput. Jurnal Tumbuhan. 81: 907-919. doi: 10.1111 / tpj.12777.
- Wieder, WR, Cleveland, CC, Lawrence, D. dan Bonau, GB (2015). Pengaruh ketidakpastian struktural caral pada proyeksi siklus karbon: fiksasi nitrogen biologis sebagai kasus studi. Surat Penelitian Lingkungan. 10 (4): 1-9. doi: 10.1088 / 1748-9326 / 10/4/044016