agar CLED (Sistin-Lactose-elektrolit-Kekurangan) adalah diferensial media kultur padat, digunakan untuk diagnosis infeksi saluran kemih. Komposisi media kultur dirancang untuk pertumbuhan patogen urin yang baik dan ideal untuk kuantifikasi unit pembentuk koloni (CFU).
Media kultur CLED tidak selektif, karena mikroorganisme Gram negatif dan Gram positif dapat tumbuh di dalamnya. Tapi ini bukan masalah, karena kebanyakan ISK hanya disebabkan oleh satu jenis mikroorganisme.
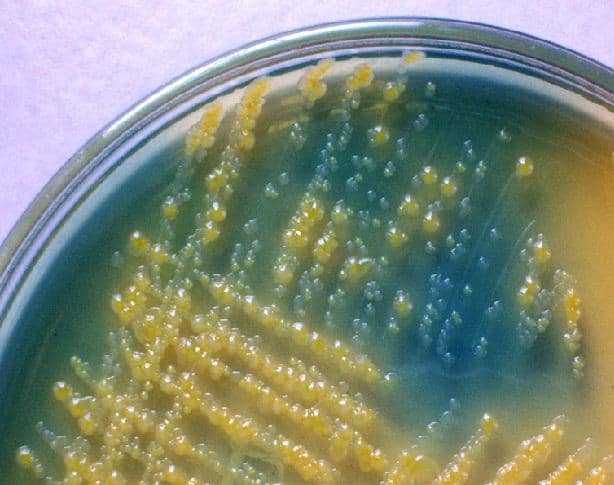
CLED agar
Dalam kasus infeksi polimikroba Anda bisa mendapatkan 2 atau 3 bakteri yang berbeda, tetapi sangat jarang dan sebagian besar waktu itu adalah sampel yang terkontaminasi.
Di antara bakteri Gram negatif yang dapat tumbuh dalam media ini adalah basil yang termasuk dalam famili Enterobacteriaceae dan basil enterik lainnya, uropatogen yang paling sering diisolasi dalam sampel urin adalah sebagai berikut: Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Morganella morganii, Pseudomonas aeruginosa , diantara yang lain.
Demikian juga di antara bakteri Gram positif yang dapat tumbuh pada media ini adalah Staphylococcus aureus, Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae, Corynebacterium sp, Lactobacillus sp dan bahkan khamir, seperti kompleks Candida albicans , dapat tumbuh .
Namun, karena komposisi kimia media, itu tidak memungkinkan pertumbuhan beberapa patogen genitourinari yang menuntut, seperti Neisseria gonorrhoeae, Gardnerella vaginalis, antara lain.
Indeks artikel
Alasan Agar CLED
medium kultur CLED memiliki ekstrak daging, hidrolisat pankreas kasein dan hidrolisat dari gelatin sebagai sumber energi. Mereka menyediakan nutrisi untuk pengembangan bakteri ringan.
Ini juga mengandung sistin, asam amino yang memungkinkan pertumbuhan coliform, yang dapat dibedakan dari ukurannya yang kecil.
Demikian juga, mengandung laktosa sebagai karbohidrat yang dapat difermentasi, karena alasan ini media ini berbeda; mampu membedakan bakteri fermentasi dari yang non-fermentasi laktosa.
Bakteri fermentasi menyebabkan pH media berubah karena produksi asam, mengembangkan koloni kuning, sedangkan bakteri non-fermentasi tidak menghasilkan perubahan dalam media, oleh karena itu mereka mengambil warna agar-agar asli, hijau.
Reaksi fermentasi terungkap berkat adanya indikator pH, yang dalam media ini adalah bromotimol biru.
Di sisi lain, konsentrasi elektrolit yang rendah dari media menghambat pertumbuhan invasif khas dari genus Proteus , yang disebut efek berkerumun. Ini menghasilkan keuntungan dibandingkan media lain, karena memungkinkan penghitungan CFU, termasuk jika genus Proteus ada.
Namun, konsentrasi elektrolit yang rendah menghambat pertumbuhan beberapa spesies genus Shigella, hal ini menjadi kelemahan dibandingkan dengan media lain.
Alasan Agar CLED (Bevis)
Ada varian atau modifikasi medium ini yang dibuat oleh Bevis, yang memasukkan asam fuchsin (indikator Andrade) ke dalam komposisi aslinya. Ia bekerja bersama dengan bromothymol blue untuk membedakan bakteri fermentasi dari non-fermentasi.
Perbedaan antara media konvensional dan media yang dimodifikasi adalah warna yang diambil oleh koloni. Dalam kasus bakteri yang memfermentasi laktosa, koloninya berwarna oranye kemerahan dengan lingkaran merah muda atau merah, sedangkan yang tidak memfermentasi berwarna abu-abu kebiruan.
Kegunaan
CLED agar digunakan secara eksklusif untuk penyemaian sampel urin. Penggunaan media ini terutama sering terjadi di laboratorium Eropa, sedangkan di Amerika lebih jarang digunakan.
Pengambilan sampel harus memenuhi parameter tertentu untuk mendapatkan hasil yang andal, antara lain:
- Tidak minum antibiotik sebelum pengambilan sampel.
- Sebaiknya ambil urin jam pertama di pagi hari, karena lebih pekat, bila tidak memungkinkan untuk mengambil sampel dengan metode invasif.
- Cuci alat kelamin dengan baik sebelum mengambil sampel.
- Buang aliran buang air kecil yang pertama lalu letakkan wadahnya.
- Kumpulkan 25 sampai 30 ml urin dalam wadah steril berlabel baik.
- Bawa segera ke laboratorium yang dikelilingi es.
- Itu harus diproses dalam waktu 2 jam setelah diterbitkan atau didinginkan pada suhu 4 ° C selama maksimal 24 jam.
Penyemaian sampel urin
Sampel urin harus diencerkan 1:50.
Untuk pengenceran, tempatkan 0,5 ml urin pasien dan encerkan dengan 24,5 ml larutan fisiologis steril.
Ukur 0,1 ml urin encer dan sebarkan permukaan dengan spatula drigalski pada media CLED. Ini adalah metode penyemaian terbaik untuk menghitung koloni. Untuk alasan ini digunakan dalam sampel urin, karena hasilnya harus dinyatakan dalam CFU / ml.
Untuk menghitung koloni yang diperoleh, lakukan sebagai berikut: hitung koloni di piring dan kalikan dengan 10 dan kemudian dengan 50. Ini memberi Anda jumlah CFU / ml urin.
Penafsiran
Hitungan di atas 100.000 CFU / ml —–Menunjukkan infeksi saluran kemih
Hitungan di bawah 1000 CFU / ml—– Tidak ada infeksi
Menghitung antara 1000-10.000 CFU / ml —– Diragukan, kemungkinan kontaminasi, pengambilan sampel ulang.
Indo
Koloni yang ditumbuhkan pada agar CLED harus memiliki Gram dan tergantung pada karakteristik morfotintorial mikroorganisme, subkultur tertentu dilakukan.
Misalnya, jika itu adalah basil Gram negatif, itu akan ditaburkan pada agar MacConkey, di mana fermentasi atau tidak laktosa dikuatkan. Selain itu, agar nutrisi dilekatkan untuk melakukan uji oksidase.
Jika Gram menunjukkan kokus Gram positif, dapat disubkultur pada agar manitol asin dan pada agar nutrisi. Dalam yang terakhir, tes katalase dilakukan. Akhirnya, jika ragi diamati, itu akan ditaburkan pada agar Sabouraud.
Banyak laboratorium menghindari penggunaan media CLED dan lebih memilih hanya menggunakan agar darah , MacConkey dan agar nutrisi untuk menjahit sampel urin.
Persiapan
Dalam labu dengan satu liter air suling, larutkan 36,2 g bubuk agar-agar CLED. Setelah 5 menit didiamkan, panaskan agar yang disuspensikan kembali, aduk terus hingga mendidih selama 1 menit.
Kemudian disterilkan pada suhu 121°C selama 15 menit dalam autoklaf. Pada akhir waktu, dikeluarkan dari autoklaf dan dibiarkan dingin hingga suhu 45 ° C. Selanjutnya, 15-20 ml disajikan dalam setiap cawan Petri steril.
Prosedur penyajian pelat harus dilakukan di dalam tudung aliran laminar atau di depan pembakar Bunsen untuk menghindari kontaminasi.
Piring yang disajikan dibiarkan mengeras, disusun dalam rak terbalik dan disimpan dalam lemari es (2-8 ° C) sampai digunakan.
PH akhir dari media yang disiapkan harus 7,3 ± 0,2.
Referensi
- Rekomendasi untuk diagnosis mikrobiologis infeksi saluran kemih. dingin. infeksius . 2001; 18 (1): 57-63. Tersedia di: scielo.org.
- Panchi J. Identifikasi agen mikroba penyebab infeksi saluran kemih pada pasien rawat inap yang menjalani kateterisasi kandung kemih. 2016. Gelar Kerja untuk memenuhi syarat gelar Sarjana Laboratorium Klinik. Universitas Teknik Ambato. Ekuador.
- Laboratorium Britannia. media CLED. Tersedia di: britanialab.com.
- Laboratorium Renylab. Petunjuk penggunaan, CLED Agar. 2013 Tersedia di: es.renylab.ind.br.
- Laboratorium Budidaya. Manual Dasar Mikrobiologi. Tersedia di: ictsl.net.
- Muñoz P, Cercenado E, Rodríguez-Créixems M, Díaz MD, Vicente T, Bouza E. Pilihan agar CLED dalam rutinitas kultur urin. Evaluasi prospektif dan komparatif. Mendiagnosis Mikrobiol Menginfeksi Dis. 1992; 15 (4): 287-90.
- García P, Paredes F, Fernández del Barrio M. (1994). Mikrobiologi klinik praktis. Universitas Cadiz, edisi ke-2. Layanan Publikasi UCA.

