Kinyoun pewarnaan adalah teknik pewarnaan yang digunakan untuk bakteri noda dan parasit alkohol tahan asam. Itu lahir dari modifikasi pewarnaan Ziehl-Neelsen ; Kedua teknik diinterpretasikan dengan cara yang sama tetapi berbeda dalam dua unsur: dalam persiapan reagen utama dan dalam teknik Kinyoun tidak menggunakan panas.
Untuk alasan ini juga dikenal sebagai pewarnaan dingin Ziehl-Neelsen atau Kinyoun yang dimodifikasi dingin. Ini diindikasikan untuk pewarnaan Mycobacterium tuberculosis , Mycobacterium leprae , mycobacteria atipikal, Nocardias sp , Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris dan Cyclosporas cayetanensis .
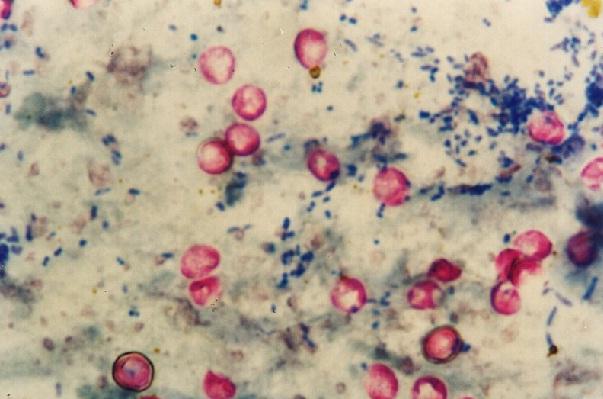
Cryptosporidium parvum diwarnai dengan pewarnaan Kinyoun. Punlop Anusonpornperm [CC BY 4.0 (https://creativecommons.org/licenses/by/4.0)], dari Wikimedia Commons
Perlu dicatat bahwa pewarnaan Nocardia lemah dengan teknik ini karena mereka sebagian tahan asam-alkohol, jadi untuk genus ini ada modifikasi metodologi.
Pada gilirannya, teknik Kinyoun dingin telah dikombinasikan dengan teknik trikrom yang dimodifikasi oleh Didier untuk mendeteksi coccidia ( Cryptosporidium parvum dan Isospora belli ) dan spora mikrosporidia ( Enterocytozoon bieneusi dan Encephalitozoon intestinalis ).
Indeks artikel
Dasar
Pereaksi pewarnaan utama adalah carbolfuchsin atau carbol fuchsin, yang memiliki sifat mengikat asam karbol dalam dinding sel lilin yang kaya lipid (asam mikolat) mikobakteri dan parasit tertentu.
Ikatan ini tidak dilawan oleh pemutih asam; oleh karena itu, mikroorganisme didefinisikan sebagai tahan asam.
Berbeda dengan teknik Ziehl-Neelsen, yang memfiksasi pewarna melalui panas, dalam teknik Kinyoun langkah ini tidak diperlukan, karena larutan karbol fuchsin yang disiapkan untuk teknik ini mengandung konsentrasi fenol yang tinggi.
Fenol melarutkan bahan lipid di dinding sel, memungkinkan pewarna karbolfuchsin masuk. Setelah pewarna menembus, ia tetap tetap meskipun dicuci dengan alkohol asam.
Dengan cara ini, mikroorganisme tahan asam mengambil warna merah yang khas, sedangkan segala sesuatu yang tidak tahan asam menjadi berubah warna dan bernoda biru.
Teknik
bahan
– Karbol fuchsin yang dimodifikasi.
– Alkohol -asam.
– Biru metilen.
Persiapan Kinyoun Carbol Fuchsin
– Fuchsin dasar: 4 gr.
– Fenol: 8 ml.
– Alkohol (95%): 20 ml.
– Air suling: 100 ml.
Fuchsin dasar harus dilarutkan perlahan dalam alkohol, aduk terus. Selanjutnya, fenol yang mengkristal dilebur dalam penangas air pada 56 ° C. Setelah larut, 8 ml ditambahkan ke larutan fuchsin yang disiapkan di atas.
Persiapan asam-alkohol
– Asam klorida pekat: 3 ml.
– Etanol (95%): 97 ml.
Itu harus diukur, digabungkan dan dicampur.
Persiapan pewarna kontras biru metilen
– Metilen biru: 0,3 g.
– Air suling: 100 ml.
Itu ditimbang dan dilarutkan.
Teknik pewarnaan Kinyoun
1- Siapkan apusan langsung dari sampel , antara lain dapat berupa sputum, cairan paru, sedimen urin, cairan serebrospinal atau feses; atau dari suspensi mikroorganisme yang diperoleh dari koloni murni yang dikembangkan dalam media kultur primer.
2- Perbaiki noda dengan panas.
3- Letakkan apusan pada jembatan pewarnaan dan tutup dengan reagen karbol fuchsin Kinyoun yang telah disiapkan. Biarkan selama 3 atau 5 menit.
4- Cuci dengan air suling.
5- Pemutih dengan alkohol asam selama 3 menit dan cuci lagi dengan air suling.
6- Pemutih lagi dengan alkohol asam selama 1 atau 2 menit sampai tidak ada lagi pewarna yang hilang.
7- Cuci dengan air suling dan biarkan mengalir, letakkan slide dalam posisi vertikal.
8- Tutup sediaan dengan metilen biru dan biarkan selama 4 menit.
9- Cuci dengan air suling dan biarkan kering.
10- Periksa pada 40X dan kemudian pada 100X.
Untuk meningkatkan dan mempercepat pewarnaan mikroorganisme tahan asam, tambahkan 1 tetes bahan pembasah (seperti Tergitol No. 7) ke dalam 30 atau 40 ml Kinyoun Carbol Fuchsin.
Beberapa laboratorium mengubah pewarna kontras biru metilen menjadi hijau terang atau asam pikrat; yang pertama memberi warna hijau pada background dan yang kedua menghasilkan warna kuning.
Teknik Kinyoun Khusus untuk Nocardias
Untuk meningkatkan pewarnaan bakteri dari genus Nocardia, modifikasi pewarnaan Kinyoun digunakan. Tekniknya adalah sebagai berikut:
1- Tutup apusan dengan Kinyoun carbol fuchsin selama 3 menit.
2- Cuci dengan air suling.
3- Menghitamkan sebentar dengan alkohol asam yang disiapkan pada 3% sampai tidak ada lagi pewarna yang terbawa.
4- Cuci kembali dengan air suling.
5- Tutup sediaan dengan metilen biru dan biarkan selama 30 detik.
6- Cuci dengan air suling dan biarkan kering.
Teknik gabungan karbol fuchsin dan trikrom yang dimodifikasi oleh Didier
Teknik ini direkomendasikan untuk analisis sampel tinja untuk spora koksidia dan Microsporidium sp secara bersamaan. Prosedur yang harus diikuti adalah sebagai berikut:
1- Tutup apusan dengan Kinyoun carbol fuchsin selama 10 menit.
2- Hapus pewarna dan cuci dengan air suling.
3- Pemutih selama 30 detik dengan alkohol asam klorida.
4- Cuci kembali dengan air suling.
5- Tutup apusan dengan larutan trikrom selama 30 menit pada suhu 37°C.
6- Cuci dengan air suling.
7- Pemutih selama 10 detik dengan alkohol asam asetat.
8- Cuci apusan selama 30 detik menggunakan etanol 95%.
QA
Sebagai kontrol positif, apusan dengan strain Mycobacterium tuberculosis disiapkan dan diwarnai dengan reagen yang disiapkan untuk memverifikasi bahwa bakteri mengambil warna yang sesuai (merah-fuchsia).
Kontrol negatif juga dapat digunakan dengan menyiapkan apusan dengan strain apa pun selain alkohol asam secara cepat, sehingga memverifikasi bahwa seluruh sampel memiliki warna yang kontras.
Teknik Kinyoun dibandingkan dengan teknik Ziehl-Neelsen
Teknik Kinyoun lebih sederhana karena menghilangkan langkah pemanasan, tetapi keuntungan utamanya adalah menghindari emisi uap, sangat beracun dan menyebabkan kanker dalam jangka panjang. Oleh karena itu, pewarnaan Kinyoun lebih aman untuk pewarnaan personel.
Penting untuk diperhatikan bahwa harus diperhatikan agar reagen tidak bersentuhan langsung dengan kulit, karena bersifat korosif dan pemutih mudah terbakar.
Mengenai kerugiannya, apusan negatif tidak selalu menunjukkan bahwa organisme itu tidak ada. Selain itu, adanya debris seluler dapat menyebabkan hasil positif palsu, yang menyebabkan kebingungan dalam diagnosis.
Referensi
- Kimia Klinis Terapan. (2016). Kit BK Kinyoun.Tersedia di: cromakit.es
- Orozco-Rico Miguel. Pewarnaan Kinyoun dan dua Coccidia pada HIV. Jurnal Kedokteran MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Diagnosa Mikrobiologi Bailey & Scott. 12 edisi Argentina. Editorial Panamericana SA
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. (edisi ke-5). Argentina, Editorial Panamericana SA
- Kontributor Wikipedia. “Noda Kinyoun.” Wikipedia, Ensiklopedia Bebas . Wikipedia, Free Encyclopedia, 8 Februari 2018. Web. 5 Januari 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Pelaksanaan teknik pewarnaan untuk diagnosis simultan Coccidia dan Microsporidia. Institut Kebersihan Universitas Republik. video monte Uruguay. Tersedia di: hygiene.edu.uy

