leucine adalah salah satu asam amino 22 merupakan protein dalam organisme hidup. Ini termasuk salah satu dari 9 asam amino esensial yang tidak disintesis oleh tubuh dan harus dikonsumsi dengan makanan yang tertelan dalam makanan.
Leusin pertama kali dijelaskan pada tahun 1818 oleh ahli kimia dan apoteker Prancis JL Proust, yang menyebutnya “oksida kaseosa.” Kemudian, Erlenmeyer dan Kunlin membuatnya dari asam -benzoylamido-β-isopropilakrilat, yang rumus molekulnya adalah C6H13NO2.
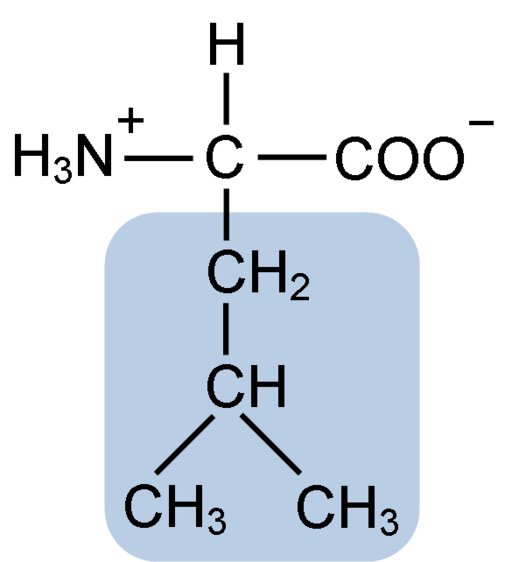
Struktur kimia asam amino Leusin (Fuene: Clavecin [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Leusin adalah kunci selama penemuan arah translasi protein, karena struktur hidrofobiknya memungkinkan ahli biokimia Howard Dintzis untuk secara radioaktif melabeli hidrogen karbon 3 dan mengamati arah di mana asam amino tergabung dalam sintesis peptida hemoglobin.
Protein yang dikenal sebagai “ritsleting” atau “penutupan” leusin, bersama dengan “jari-jari seng”, merupakan faktor transkripsi terpenting dalam organisme eukariotik. Ritsleting leusin dicirikan oleh interaksi hidrofobiknya dengan DNA .
Umumnya, protein yang kaya leusin atau terdiri dari asam amino rantai cabang tidak dimetabolisme di hati, melainkan langsung ke otot di mana mereka digunakan dengan cepat untuk sintesis protein dan produksi energi.
Leusin adalah asam amino rantai bercabang yang diperlukan untuk biosintesis protein susu dan asam amino, yang disintesis di kelenjar susu. Sejumlah besar asam amino ini dapat ditemukan dalam bentuk bebas dalam ASI.
Di antara semua asam amino yang membentuk protein, leusin dan arginin adalah yang paling melimpah dan keduanya telah terdeteksi dalam protein dari semua kingdom yang membentuk pohon kehidupan.
Indeks artikel
Karakteristik
Leusin dikenal sebagai asam amino rantai cabang esensial, ia berbagi struktur khas dengan asam amino lainnya. Namun, ini dibedakan karena rantai samping atau gugus R-nya memiliki dua karbon yang terikat linier, dan yang terakhir terikat pada atom hidrogen dan dua gugus metil.
Itu milik kelompok asam amino polar yang tidak bermuatan, substituen atau gugus R dari asam amino ini bersifat hidrofobik dan nonpolar. Asam amino ini terutama bertanggung jawab untuk interaksi hidrofobik intra dan antar protein dan cenderung menstabilkan struktur protein.
Semua asam amino, yang memiliki karbon pusat yang kiral (α karbon), yaitu memiliki empat substituen yang berbeda, dapat ditemukan dalam dua bentuk yang berbeda di alam; dengan demikian, ada D- dan L-leusin, yang terakhir khas dalam struktur protein.
Kedua bentuk setiap asam amino memiliki sifat yang berbeda, berpartisipasi dalam jalur metabolisme yang berbeda dan bahkan dapat memodifikasi karakteristik struktur di mana mereka menjadi bagiannya.
Misalnya, leusin dalam bentuk L-leusin memiliki rasa yang agak pahit, sedangkan dalam bentuk D-leusinnya sangat manis.
Bentuk L dari asam amino apa pun lebih mudah dimetabolisme oleh tubuh mamalia. L-leusin mudah terdegradasi dan digunakan untuk konstruksi dan perlindungan protein.
Struktur
Leusin terdiri dari 6 atom karbon. Karbon pusat, umum di semua asam amino, melekat pada gugus karboksil (COOH), gugus amino (NH2), atom hidrogen (H) dan rantai samping atau gugus R yang terdiri dari 4 atom karbon.
Atom karbon dalam asam amino dapat diidentifikasi dengan huruf Yunani. Penomoran dimulai dari karbon asam karboksilat (COOH), sedangkan anotasi dengan alfabet Yunani dimulai dari karbon pusat.
Leusin memiliki gugus substituen dalam rantai R-nya sebuah gugus isobutil atau 2-metilpropil yang dihasilkan oleh hilangnya atom hidrogen, dengan pembentukan radikal alkil; Kelompok-kelompok ini muncul sebagai cabang dalam struktur asam amino.
Fitur
Leusin adalah asam amino yang dapat berfungsi sebagai prekursor ketogenik untuk senyawa lain yang terlibat dalam siklus asam sitrat. Asam amino ini merupakan sumber penting untuk sintesis asetil-KoA atau asetoasetil-KoA, yang merupakan bagian dari jalur pembentukan badan keton di sel hati.
Leusin diketahui penting dalam jalur pensinyalan insulin, untuk berpartisipasi dalam inisiasi sintesis protein, dan untuk mencegah kehilangan protein melalui degradasi.
Biasanya, struktur internal protein terdiri dari asam amino hidrofobik seperti leusin, valin, isoleusin, dan metionin. Struktur seperti itu biasanya dilestarikan untuk enzim yang umum di antara organisme hidup, seperti dalam kasus Sitokrom C.
Leusin dapat mengaktifkan jalur metabolisme dalam sel-sel kelenjar susu untuk merangsang sintesis laktosa, lipid dan protein yang berfungsi sebagai molekul sinyal dalam pengaturan homeostasis energi muda pada mamalia.
Domain kaya leusin adalah bagian penting dari protein pengikat DNA spesifik, yang umumnya dimer struktural dalam bentuk superkoil dan dikenal sebagai “protein ritsleting leusin.”
Protein-protein ini memiliki ciri khas pola teratur leusin berulang bersama dengan asam amino hidrofobik lainnya yang bertanggung jawab untuk mengatur pengikatan faktor transkripsi ke DNA dan antara faktor transkripsi yang berbeda.
Protein ritsleting leusin dapat membentuk homo atau heterodimer yang memungkinkan mereka untuk mengikat ke daerah tertentu dari faktor transkripsi untuk mengatur pasangan mereka dan interaksi mereka dengan molekul DNA yang mereka atur.
Biosintesis
Semua asam amino rantai cabang, termasuk leusin, terutama disintesis pada tumbuhan dan bakteri. Pada tanaman berbunga ada peningkatan yang signifikan dalam produksi leusin, karena merupakan prekursor penting untuk semua senyawa yang bertanggung jawab atas aroma bunga dan buah-buahan.
Salah satu faktor yang menyebabkan kelimpahan besar leusin dalam peptida bakteri yang berbeda dikaitkan adalah bahwa 6 kodon berbeda dari kode kode genetik untuk leusin (UUA-UUG-CUU-CUC-CUA-CUG), hal yang sama juga berlaku untuk arginin.
Leusin disintesis dalam bakteri melalui rute lima langkah yang menggunakan asam keto yang terkait dengan valin sebagai titik awal.
Proses ini diatur secara alosterik, sehingga ketika ada kelebihan leusin di dalam sel, itu menghambat enzim yang berpartisipasi dalam jalur dan menghentikan sintesis.
Jalur biosintetik
Biosintesis leusin pada bakteri dimulai dengan konversi turunan asam keto valin, 3-metil-2-oksobutanoat menjadi (2S) -2-isopropilmalat, berkat kerja enzim 2-isopropilmalto sintase, yang menggunakan asetil-Koa dan air untuk tujuan ini.
(2S) -2-isopropil malat kehilangan satu molekul air dan diubah menjadi 2-isopropilmaleat oleh 3-isopropil malat dehidratase. Selanjutnya, enzim yang sama menambahkan molekul air lain dan mengubah 2-isopropilmaleat menjadi (2R-3S) -3-isopropilmalat.
Senyawa terakhir ini mengalami reaksi oksidoreduksi yang memerlukan partisipasi molekul NAD +, yang dengannya (2S) -2-isopropil-3-oksosuksinat diproduksi, yang dimungkinkan dengan partisipasi enzim 3- isopropil malat dehidrogenase.
(2S) -2-isopropil-3-oksosuksinat kehilangan atom karbon dalam bentuk CO2 secara spontan, menghasilkan 4-metil-2-oksopentanoat yang, dengan aksi rantai cabang asam amino transaminase (leusin transaminase, khususnya) dan bersamaan dengan pelepasan L-glutamat dan 2-oksoglutarat, ia menghasilkan L-leusin.
Degradasi
Peran utama leusin adalah bertindak sebagai perangkat sinyal yang memberi tahu sel bahwa ada cukup asam amino dan energi untuk memulai sintesis protein otot.
Pemecahan asam amino rantai bercabang seperti leusin dimulai dengan transaminasi. Ini dan dua langkah enzimatik berikutnya dikatalisis oleh tiga enzim yang sama dalam kasus leusin, isoleusin, dan valin.
Transaminasi ketiga asam amino menghasilkan turunan asam -ketonya, yang mengalami dekarboksilasi oksidatif untuk menghasilkan , tioester asil-KoA -dehidrogenasi untuk menghasilkan , tioester asil-KoA -tak jenuh.
Selama katabolisme leusin, tioester asil-KoA , -tak jenuh yang sesuai digunakan untuk menghasilkan asetoasetat (asam asetoasetat) dan asetil-KoA melalui jalur yang melibatkan metabolit 3-hidroksi-3-metilglutaril-KoA.(HMG-CoA ), yang merupakan perantara dalam biosintesis kolesterol dan isoprenoid lainnya.
Jalur Katabolik Leusin
Dari pembentukan tioester asil-CoA -tak jenuh yang berasal dari leusin, jalur katabolik untuk asam amino ini dan untuk valin dan isoleusin sangat berbeda.
Tioester asil-CoA , -tak jenuh dari leusin diproses di hilir oleh tiga enzim berbeda yang dikenal sebagai (1) 3-metilkrotonil-KoA karboksilase, (2) 3-metilglutakonil-KoA hidratase dan (3) 3-hidroksi -3- metilglutaril-KoA liase.
Pada bakteri, enzim ini bertanggung jawab untuk konversi 3-methylcrotonyl-CoA (berasal dari leusin) menjadi 3-methylglutaconyl-CoA, 3-hydroxy-3-methylglutaryl-CoA, dan acetoacetate dan acetyl-CoA, masing-masing.
Leusin yang tersedia dalam darah digunakan untuk sintesis protein otot / myofibrillar (MPS). Ini bertindak sebagai faktor pengaktif dalam proses ini. Juga, ia berinteraksi langsung dengan insulin, mempengaruhi pasokan insulin.
Makanan kaya leusin
Konsumsi protein yang kaya akan asam amino sangat penting untuk fisiologi seluler organisme hidup dan leusin tidak terkecuali di antara asam amino esensial.
Protein yang diperoleh dari whey dianggap paling kaya dalam residu L-leusin. Namun, semua makanan berprotein tinggi seperti ikan, ayam, telur, dan daging merah menyediakan leusin dalam jumlah besar bagi tubuh.
Biji jagung kekurangan asam amino lisin dan triptofan, memiliki struktur tersier yang sangat kaku untuk pencernaan dan memiliki nilai yang kecil dari sudut pandang nutrisi, namun biji jagung memiliki kadar leusin dan isoleusin yang tinggi.
Buah tanaman polongan kaya akan hampir semua asam amino esensial: lisin, treonin, isoleusin, leusin, fenilalanin dan valin, tetapi rendah metionin dan sistein.
Leusin diekstraksi, dimurnikan dan dipekatkan dalam tablet sebagai suplemen makanan untuk atlet kompetisi tinggi dan dipasarkan sebagai obat. Sumber utama untuk isolasi asam amino ini adalah tepung kedelai yang dihilangkan lemaknya.
Ada suplemen makanan yang digunakan oleh atlet untuk regenerasi otot yang dikenal sebagai BCAA ( Branched Chain Amino Acids ). Ini memberikan konsentrasi tinggi asam amino rantai cabang: leusin, valin dan isoleusin.
Manfaat asupannya
Makanan kaya leusin membantu mengendalikan obesitas dan penyakit metabolik lainnya. Banyak ahli gizi menunjukkan bahwa makanan yang kaya leusin dan suplemen makanan berdasarkan asam amino ini berkontribusi pada pengaturan nafsu makan dan kecemasan pada orang dewasa.
Semua protein yang kaya leusin merangsang sintesis protein otot; Telah ditunjukkan bahwa peningkatan proporsi leusin yang dicerna sehubungan dengan asam amino esensial lainnya dapat membalikkan pelemahan sintesis protein pada otot pasien usia lanjut.
Bahkan orang dengan gangguan makula parah yang lumpuh dapat menghentikan hilangnya massa dan kekuatan otot dengan suplementasi leusin oral yang benar, selain menerapkan latihan resistensi otot sistemik.
Leusin, valin dan isoleusin adalah komponen penting dari massa yang membentuk otot rangka hewan vertebrata , sehingga kehadiran mereka sangat penting untuk sintesis protein baru atau untuk perbaikan yang sudah ada.
Gangguan kekurangan
Kekurangan atau malformasi kompleks enzim -ketoacid dehydrogenase, yang bertanggung jawab untuk metabolisme leusin, valin, dan isoleusin pada manusia, dapat menyebabkan gangguan mental yang parah.
Selain itu, terdapat kondisi patologis yang berhubungan dengan metabolisme asam amino rantai cabang ini yang disebut “Penyakit Urine Sirup Maple”.
Sampai saat ini, adanya efek samping dalam konsumsi leusin yang berlebihan belum dibuktikan. Namun, dosis maksimum 550 mg/kg setiap hari dianjurkan, karena belum ada penelitian jangka panjang terkait paparan jaringan yang berlebihan terhadap asam amino ini.
Referensi
- lava, MDC, Camacho, ME, & Delgadillo, J. (2012). Kesehatan otot dan pencegahan sarkopenia: efek protein, leusin dan -hidroksi-ß-metilbutirat. Jurnal Metabolisme Tulang dan Mineral , 10 (2), 98-102.
- Fennema, ATAU (1993). Kimia makanan (No. 664: 543). Acribia
- Massey, LK, Sokatch, JR, & Conrad, RS (1976). Katabolisme asam amino rantai cabang pada bakteri. Ulasan bakteriologis , 40 (1), 42.
- Mathews, CK, & Ahern, KG (2002). Biokimia . Pendidikan Pearson.
- Mero, A. (1999). Suplementasi leusin dan pelatihan intensif. Kedokteran Olahraga , 27 (6), 347-358.
- Munro, HN (Ed.). (2012). Metabolisme protein mamalia (Vol. 4). Elsevier
- Nelson, DL, Lehninger, AL, & Cox, MM (2008). Prinsip-prinsip biokimia Lehninger . Macmillan.

