myofibrils adalah unit struktural sel-sel otot, juga dikenal sebagai serat otot. Mereka sangat melimpah, mereka diatur secara paralel dan mereka tertanam oleh sitosol sel-sel ini.
Sel atau serat otot lurik adalah sel yang sangat panjang, berukuran panjang hingga 15 cm dan diameter 10 hingga 100 m. Membran plasmanya disebut sarcolemma dan sitosolnya disebut sarkoplasma.
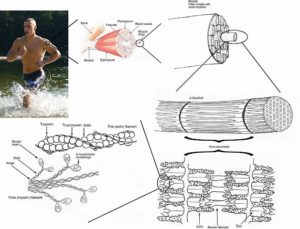
Diagram struktur otot manusia (Sumber: Deglr6328 ~ commonswiki, via Wikimedia Commons)
Di dalam sel-sel ini, selain miofibril, banyak inti dan mitokondria yang dikenal sebagai sarkosom, serta retikulum endoplasma menonjol yang dikenal sebagai retikulum sarkoplasma.
Miofibril dikenal sebagai “unsur kontraktil” otot pada hewan vertebrata . Mereka terdiri dari beberapa jenis protein yang memberi mereka karakteristik elastis dan dapat ditarik. Selain itu, mereka menempati bagian penting dari sarkoplasma serat otot.
Indeks artikel
Perbedaan antara serat otot
Ada dua jenis serat otot: serat lurik dan serat halus, masing-masing dengan distribusi anatomi dan fungsi tertentu. Miofibril sangat penting dan terbukti dalam serat otot lurik yang membentuk otot rangka.
Serat lurik menunjukkan pola pita melintang yang berulang ketika diamati di bawah mikroskop dan berhubungan dengan otot rangka dan bagian dari otot jantung.
Serat halus, sebaliknya, tidak menunjukkan pola yang sama di bawah mikroskop dan ditemukan di otot-otot khas dari pembuluh darah dan sistem pencernaan (dan semua jeroan).
Karakteristik umum
Miofibril terdiri dari dua jenis filamen kontraktil (juga dikenal sebagai miofilamen), yang pada gilirannya terdiri dari protein berfilamen miosin dan aktin, yang akan dijelaskan nanti.
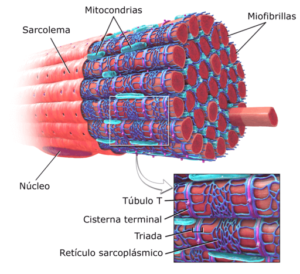
Representasi grafis miofibril di otot rangka (Sumber: Dimodifikasi dari BruceBlaus [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] melalui Wikimedia Commons)
Peneliti yang berbeda telah menentukan bahwa waktu paruh protein kontraktil miofibril berkisar antara 5 hari hingga 2 minggu, sehingga otot adalah jaringan yang sangat dinamis, tidak hanya dari sudut pandang kontraktil, tetapi juga dari sintesis dan pembaruan. sudut pandang unsur strukturalnya.
Unit fungsional dari setiap miofibril dalam sel atau serat otot disebut sarkomer dan dibatasi oleh daerah yang dikenal sebagai “pita atau garis Z”, dari mana miofilamen aktin memanjang dalam urutan paralel.
Karena miofibril menempati sebagian besar sarkoplasma, struktur fibrosa ini membatasi lokasi nukleus sel di mana mereka berada di tepi sel, dekat dengan sarkolema.
Beberapa patologi manusia terkait dengan perpindahan nukleus ke dalam bundel myofibrillar, dan ini dikenal sebagai miopati sentro-nuklear.
Pembentukan miofibril atau “myofibrillogenesis”
Miofibril pertama dirakit selama perkembangan otot rangka embrionik.
Protein yang membentuk sarkomer (unit fungsional miofibril) awalnya disejajarkan dari ujung dan sisi “premiofibril” yang terdiri dari filamen aktin dan sebagian kecil miosin II non-otot dan -aktin spesifik otot.
Saat ini terjadi, gen yang mengkode isoform jantung dan rangka dari -aktin diekspresikan dalam proporsi yang berbeda dalam serat otot. Pertama jumlah isoform jantung yang diekspresikan lebih besar dan kemudian ini berubah ke arah kerangka.
Setelah pembentukan premiofibril, miofibril yang baru lahir berkumpul di belakang zona pembentukan premiofibril dan dalam hal ini bentuk otot miosin II terdeteksi.
Pada titik ini, filamen miosin sejajar dan kompleks dengan protein pengikat miosin spesifik lainnya, yang juga terjadi dengan filamen aktin.
Struktur dan komposisi
Seperti yang telah dibahas beberapa saat yang lalu, miofibril terdiri dari miofilamen protein kontraktil: aktin dan miosin, yang masing-masing juga dikenal sebagai miofilamen tipis dan tebal. Ini terlihat di bawah mikroskop cahaya.
– Miofilamen tipis
Filamen tipis miofibril terdiri dari protein aktin dalam bentuk filamennya (aktin F), yang merupakan polimer bentuk globular (aktin G), yang ukurannya lebih kecil.
Untaian filamen G-aktin (F-aktin) membentuk untai ganda yang melilit menjadi heliks. Masing-masing monomer ini memiliki berat sekitar 40 kDa dan mampu mengikat miosin pada tempat tertentu.
Filamen ini berdiameter sekitar 7 nm dan membentang di antara dua area yang dikenal sebagai pita I dan pita A. Dalam pita A, filamen ini disusun di sekitar filamen tebal dalam susunan heksagonal sekunder.
Secara khusus, setiap filamen tipis dipisahkan secara simetris dari tiga filamen tebal, dan setiap filamen tebal dikelilingi oleh enam filamen tipis.
Filamen tipis dan tebal berinteraksi satu sama lain melalui “jembatan silang” yang menonjol dari filamen tebal dan muncul dalam struktur miofibril pada interval reguler dengan jarak mendekati 14 nm.
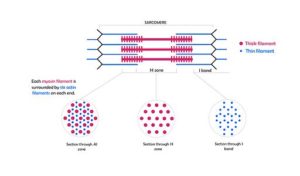
Representasi skematis miofilamen yang membentuk miofibril dan penampang melintangnya (Sumber: Kamran Maqsood 93 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Filamen aktin dan protein terkait lainnya memanjang di atas “tepi” garis Z dan tumpang tindih dengan filamen miosin menuju pusat setiap sarkomer.
– Miofilamen tebal
Filamen tebal adalah polimer dari protein myosin II (masing-masing 510 kDa) dan dibatasi oleh daerah yang dikenal sebagai “pita A”.
Miofilamen miosin panjangnya kira-kira 16 nm dan tersusun dalam susunan heksagonal (jika penampang miofibril diamati).
Setiap filamen miosin II terdiri dari banyak molekul miosin yang dikemas, masing-masing terdiri dari dua rantai polipeptida yang memiliki daerah berbentuk tongkat atau “kepala” dan yang disusun dalam “bundel” untuk membentuk filamen.
Kedua berkas diikat pada ujung-ujungnya di tengah setiap sarkomer, sehingga “kepala” setiap miosin diarahkan ke garis Z, tempat filamen tipis melekat.
Kepala miosin memenuhi fungsi yang sangat penting, karena mereka memiliki tempat pengikatan untuk molekul ATP dan, sebagai tambahan, selama kontraksi otot, mereka mampu membentuk jembatan silang untuk berinteraksi dengan filamen aktin tipis.
– Protein terkait
Filamen aktin “berlabuh” atau “tetap” ke membran plasma serat otot (sarcolemma) berkat interaksinya dengan protein lain yang dikenal sebagai distrofin.
Selain itu, ada dua protein pengikat aktin penting yang dikenal sebagai troponin dan tropomiosin yang, bersama dengan filamen aktin, membentuk kompleks protein. Kedua protein sangat penting untuk pengaturan interaksi yang terjadi antara filamen tipis dan tebal.
Tropomiosin juga merupakan molekul berfilamen dua untai yang berasosiasi dengan heliks aktin khususnya di wilayah alur antara dua untai. Troponin adalah kompleks protein globular tripartit yang tersusun dalam interval pada filamen aktin.
Kompleks terakhir ini berfungsi sebagai “saklar” yang bergantung pada kalsium yang mengatur proses kontraksi serat otot, oleh karena itu sangat penting.
Selain itu, pada otot lurik hewan vertebrata, ada dua protein lain yang berinteraksi dengan filamen tebal dan tipis, masing-masing dikenal sebagai titin dan nebulin.
Nebulin memiliki fungsi penting dalam mengatur panjang filamen aktin, sementara titin berpartisipasi dalam mendukung dan menambatkan filamen miosin di wilayah sarkomer yang dikenal sebagai garis M.
Protein lainnya
Ada protein lain yang berasosiasi dengan miofilamen tebal yang dikenal sebagai protein pengikat miosin C dan miomesin, yang bertanggung jawab untuk fiksasi filamen miosin di garis M.
Fitur
Miofibril memiliki implikasi dasar untuk mobilitas hewan vertebrata.
Karena mereka dibentuk oleh kompleks protein berserat dan kontraktil dari aparatus otot, ini penting untuk melaksanakan respons terhadap rangsangan saraf yang mengarah pada gerakan dan perpindahan (pada otot lurik rangka).
Sifat dinamis tak terbantahkan dari otot rangka, yang terdiri lebih dari 40% dari berat badan , diberikan oleh miofibril yang, pada saat yang sama, memiliki antara 50 dan 70% protein dalam tubuh manusia.
Miofibril, sebagai bagian dari otot-otot ini, berpartisipasi dalam semua fungsinya:
– Mekanik : mengubah energi kimia menjadi energi mekanik untuk menghasilkan tenaga, mempertahankan postur, menghasilkan gerakan, dll.
– Metabolik : karena otot berpartisipasi dalam metabolisme energi basal dan berfungsi sebagai tempat penyimpanan zat-zat dasar seperti asam amino dan karbohidrat; itu juga berkontribusi pada produksi panas dan konsumsi energi dan oksigen yang digunakan selama aktivitas fisik atau latihan olahraga.
Karena miofibril sebagian besar terdiri dari protein, miofibril mewakili tempat penyimpanan dan pelepasan asam amino yang berkontribusi pada pemeliharaan kadar glukosa darah selama puasa atau kelaparan.
Juga, pelepasan asam amino dari struktur otot ini penting dari sudut pandang kebutuhan biosintetik jaringan lain seperti kulit, otak, jantung dan organ lainnya.
Referensi
- Despopoulos, A., & Silbernagl, S. (2003). Atlas Warna Fisiologi (edisi ke-5). New York: Tema.
- Friedman, AL, & Goldman, YE (1996). Karakterisasi mekanik miofibril otot rangka. Jurnal Biofisika , 71 (5), 2774-2785.
- Frontera, WR, & Ochala, J. (2014). Otot Rangka: Tinjauan Singkat Struktur dan Fungsi. Calcif Tissue Int , 45 (2), 183–195.
- Goldspink, G. (1970). Proliferasi Myofibrils selama pertumbuhan serat otot. J. Sel Sct. , 6 , 593-603.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Biokimia Harper’s Illustrated (edisi ke-28). McGraw-Hill Medis.
- Rosen, JN, & Baylies, MK (2017). Miofibril menekan inti. Biologi Sel Alam , 19 (10).
- Sanger, J., Wangs, J., Fan, Y., White, J., Mi-Mi, L., Dube, D.,… Pruyne, D. (2016). Perakitan dan Pemeliharaan Miofibril pada Otot Lurik. Dalam Buku Pegangan Farmakologi Eksperimental (hal. 37). New York, AS: Penerbitan Internasional Springer Swiss.
- Sanger, JW, Wang, J., Fan, Y., Putih, J., & Sanger, JM (2010). Perakitan dan Dinamika Miofibril. Jurnal Biomedis dan Bioteknologi , 2010 , 8.
- Sobieszek, A., & Bremel, R. (1975). Persiapan dan Sifat Vertebrata Halus – Otot Miofibril dan Aktomiosin. Jurnal Biokimia Eropa , 55 (1), 49–60.
- Villee, C., Walker, W., & Smith, F. (1963). Zoologi Umum (edisi ke-2). London: Perusahaan WB Saunders.

