cadherin adalah transmembran glikoprotein kalsium tergantung dan bertanggung jawab untuk menjaga hubungan antara sel-sel yang menjaga integritas jaringan pada hewan. Ada lebih dari 20 jenis cadherin yang berbeda, semuanya dengan sekitar 750 asam amino, dan khusus untuk berbagai jenis sel.
Sambungan sel yang dicapai oleh cadherin stabil dari waktu ke waktu. Oleh karena itu, molekul-molekul ini berperan penting dalam perkembangan bentuk organisme selama perkembangan embrio (morfogenesis), serta dalam pemeliharaan struktur jaringan baik pada tahap embrio maupun pada kehidupan dewasa.
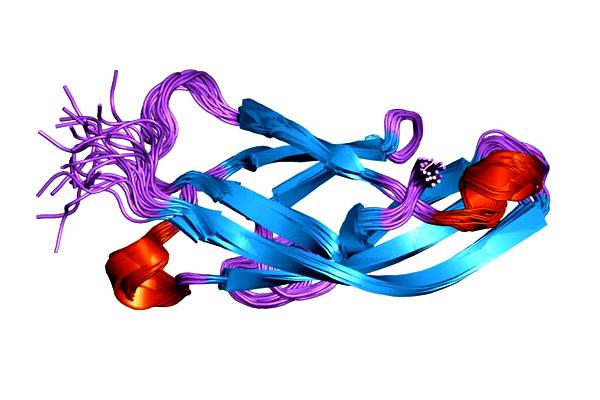
Representasi molekuler dari protein 1suh, E-cadherin (epitel). Diambil dan diedit dari: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik].
Kerusakan cadherin dikaitkan dengan perkembangan berbagai jenis kanker. Defisiensi adhesi sel melalui cadherin merupakan salah satu penyebab peningkatan motilitas sel tumor.
Indeks artikel
Molekul adhesi sel
Dalam organisme multiseluler, sel harus bersatu untuk berpartisipasi dalam keragaman besar proses biologis yang memungkinkan mempertahankan integritas mereka, sehingga membedakan diri dari organisme uniseluler kolonial. Proses ini termasuk, tetapi tidak terbatas pada, hemostasis, respon imun, morfogenesis, dan diferensiasi.
Molekul-molekul ini berbeda dalam strukturnya, serta fungsinya, menjadi empat kelompok: integrin, selektin, imunoglobulin, dan cadherin.
Sejarah
Sejarah cadherin sangat singkat, karena mereka hanya dikenal untuk waktu yang singkat. Jadi, cadherin pertama ditemukan dalam sel dari jaringan tikus pada tahun 1977. Para ilmuwan menyebut molekul ini uvomorulin.
Pada 1980-an, banyak molekul cadherin lainnya ditemukan dalam jaringan dari berbagai spesies. Cadherin ini ditemukan dalam uji agregasi sel yang bergantung pada kalsium. Semuanya termasuk dalam kelompok molekul yang sama yang disebut cadherin klasik.
Dalam beberapa tahun terakhir, dan berkat kemajuan dalam biologi molekuler, para ilmuwan telah berhasil mengidentifikasi sejumlah cadherin penting lainnya, beberapa di antaranya fungsi spesifiknya tidak diketahui, dan yang mungkin memiliki fungsi selain adhesi sel.
Struktur
Cadherin adalah glikoprotein, yaitu molekul yang dibentuk oleh asosiasi protein dan karbohidrat. Mereka terdiri dari antara 700 (biasanya 750) dan 900 asam amino, dan memiliki domain fungsional yang berbeda, yang memungkinkan mereka berinteraksi dengan molekul cadherin lain dan ion kalsium.
Domain fungsional juga memungkinkan cadherin untuk berintegrasi ke dalam membran plasma, serta untuk berasosiasi dengan sitoskeleton aktin. Sebagian besar rantai asam amino terletak di wilayah ekstraseluler dan biasanya dibedakan menjadi lima domain, yang disebut EC (EC1-EC5).
Masing-masing domain ini memiliki sekitar 100 asam amino, dengan satu atau dua situs pengikatan kalsium. Daerah transmembran terletak di antara bagian luar dan dalam sel dan melintasi membran hanya sekali.
Di sisi lain, porsi cadherin yang ditemukan di dalam sel sangat konservatif dan terdiri dari 150 asam amino. Domain ini mengikat sitoskeleton aktin melalui protein sitosol yang disebut catenin.
Jenis
Ada lebih dari 20 jenis cadherin yang berbeda, yang diklasifikasikan dengan cara yang berbeda tergantung pada penulisnya. Jadi, misalnya, beberapa penulis mengenali dua kelompok atau subfamili, sementara yang lain mengenali enam. Menurut yang pertama, cadherin dapat dibagi menjadi:
Cadherine Klasik atau Tipe I
Juga disebut cadherin tradisional. Termasuk dalam kelompok ini adalah cadherin yang diberi nama sesuai dengan jaringan tempat ditemukannya pertama kali, seperti E-cadherin (epitel), N-cadherin (neural), P-cadherin (plasenta), L-cadherin ( hati) dan R- cadherin (retina). Namun, glikoprotein ini dapat ditemukan di jaringan yang berbeda.
Misalnya, N-cadherin, selain terdapat di jaringan saraf, juga dapat dilokalisasi di jaringan testis, ginjal, hati, dan otot jantung.
Caderin atipikal atau Tipe II
Disebut juga non-tradisional atau non-klasik. Mereka termasuk desmoglein dan desmocholins, yang membentuk persimpangan pada tingkat desmosom antar sel. Ada juga protocadherin, yang ditandai dengan kurangnya koneksi ke sitoskeleton aktin.
Semua cadherin ini dipisahkan dari yang non-tradisional, oleh beberapa penulis, menjadi tiga kelompok independen. Cadherin atipikal lainnya termasuk T-cadherin, yang tidak memiliki domain transmembran dan sitoplasma, dan varian E-cadherin, yang ditemukan di luar sel dan disebut Evar-cadherin.
Karakteristik
Mereka adalah glikoprotein yang bergantung pada kalsium yang ditemukan hampir secara eksklusif di jaringan hewan. Kebanyakan dari mereka adalah transmembran single-pass; yaitu, mereka hadir dalam membran sel, melintasinya dari sisi ke sisi hanya sekali.
Cadherin berpartisipasi terutama dalam penyatuan antara sel-sel yang menyajikan karakteristik fenotipik semilar (ikatan homotipik atau homofilik). Ikatan sel yang dibuat oleh molekul-molekul ini (ikatan cadherin-cadherin) sekitar 200 kali lebih kuat dari ikatan protein-protein lainnya.
Dalam cadherin tradisional, domain sitoplasmik sangat konservatif. Ini berarti komposisinya serupa pada cadherin yang berbeda.
Fitur
Fungsi utama cadherin adalah untuk memungkinkan penyatuan sel permanen dari waktu ke waktu, yang memainkan peran mendasar dalam proses seperti perkembangan embrio, morfogenesis, diferensiasi dan pemeliharaan struktural jaringan epitel di kulit dan usus, serta pembentukan akson.
Fungsi ini diatur sebagian oleh terminal -COOH yang ada di bagian intraseluler atau domain glikoprotein. Terminal ini berinteraksi dengan molekul yang disebut catenin, yang pada gilirannya berinteraksi dengan unsur sitoskeleton sel.
Fungsi lain dari cadherin termasuk selektivitas (memilih sel lain untuk bergabung) dan pensinyalan sel, pembentukan polaritas sel, dan regulasi apoptosis. Yang terakhir adalah mekanisme kematian sel yang dikendalikan secara internal oleh organisme yang sama untuk mengatur perkembangannya.
Cadherin dan kanker
Kerusakan cadherin berimplikasi pada perkembangan berbagai jenis kanker. Kerusakan ini mungkin karena modifikasi ekspresi cadherin dan catenin, serta aktivasi sinyal yang mencegah sel bergabung.
Dengan gagalnya pengikatan sel cadherin, ini memungkinkan sel tumor meningkatkan motilitasnya dan dilepaskan, untuk kemudian menyerang jaringan yang berdekatan melalui kelenjar getah bening dan pembuluh darah.
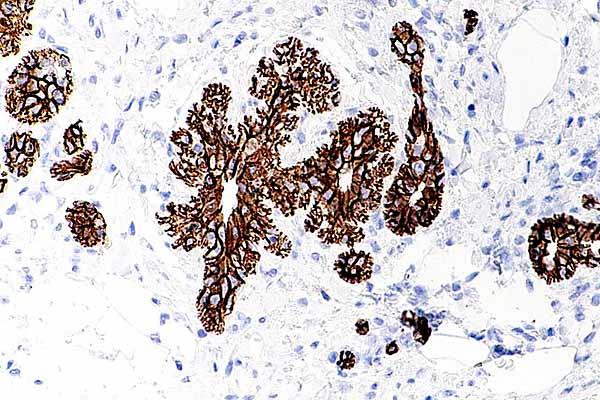
E-Cadherina Benigma dari payudara. Mikrograf hiperplasia lobular atipikal. Diambil dan diedit dari: Nephron [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)].
Ketika sel-sel ini mencapai organ target, mereka menyerang dan berkembang biak, memperoleh karakter invasif dan metastasis. Sebagian besar penelitian yang mengaitkan cadherin dengan proses pertumbuhan karsinogenik berfokus pada E-cadherin.
Jenis cadherin ini terlibat dalam kanker usus besar, perut, payudara, ovarium dan paru-paru, antara lain. Namun, ini bukan satu-satunya cadherin yang terkait dengan kanker. N-cadherin, misalnya, berperan dalam mesothelioma pleura dan rhabdomyosarcomas.
Referensi
- Kaderin. Di Wikipedia. Dipulihkan dari en.wikipedia.org
- D. Leckband & A. Prakasam (2006). Mekanisme dan dinamika adhesi cadherin. Review Tahunan Teknik Biomedis.
- F. Nolletl, P. Kools P, & F. Van Roy (2000). Analisis Filogenetik Superfamili Cadherin memungkinkan Identifikasi Enam Subfamili Utama Selain Beberapa Anggota Soliter. Jurnal Biologi Molekuler.
- J. Günther & E. Pedernera-Astegiano (2011). E-cadherin: unsur kunci dalam transformasi neoplastik. Jurnal Bukti dan Penelitian Klinis.
- L. Petruzzelli, M. Takita & D. Humes (1999). Struktur dan Fungsi Molekul Adhesi Sel. Jurnal Kedokteran Amerika.
- U. Cavallaro & G. Christofori (2004). Adhesi sel dan pensinyalan oleh cadherin dan Ig-CAM s pada kanker. Ulasan Alam Kanker.

