Sebuah larutan isotonik adalah salah satu yang menyajikan konsentrasi yang sama dari zat terlarut sehubungan dengan solusi dipisahkan atau diisolasi oleh penghalang semipermeabel. Penghalang ini memungkinkan pelarut melewatinya, tetapi tidak semua partikel zat terlarut.
Dalam fisiologi, larutan terisolasi tersebut mengacu pada cairan intraseluler, yaitu bagian dalam sel; sedangkan penghalang semi-permeabel sesuai dengan membran sel, dibentuk oleh lapisan ganda lipid di mana molekul air dapat disaring ke dalam media ekstraseluler.
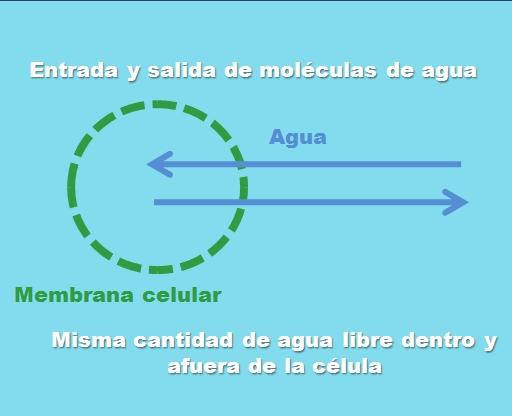
Interaksi sel dengan larutan isotonik. Sumber: Gabriel Bolivar.
Gambar di atas menggambarkan apa yang dimaksud dengan larutan isotonik. “Konsentrasi” air adalah sama di dalam dan di luar sel, sehingga molekulnya masuk atau keluar melalui membran sel dengan frekuensi yang sama. Oleh karena itu, jika dua molekul air masuk ke dalam sel, dua di antaranya akan keluar secara bersamaan ke lingkungan ekstraseluler.
Keadaan ini, yang disebut isotonisitas, hanya terjadi ketika media berair, di dalam dan di luar sel, mengandung jumlah partikel terlarut yang sama. Dengan demikian, larutan akan menjadi isotonik jika konsentrasi zat terlarutnya sama dengan cairan atau media intraseluler. Misalnya, saline 0,9% bersifat isotonik.
Indeks artikel
Komponen larutan isotonik
Agar ada larutan isotonik, pertama-tama Anda harus memastikan bahwa osmosis terjadi dalam larutan atau media pelarut dan bukan difusi zat terlarut. Ini hanya mungkin jika ada penghalang semi-permeabel, yang memungkinkan molekul pelarut melewatinya, tetapi bukan molekul zat terlarut, terutama zat terlarut bermuatan listrik, ion.
Dengan demikian, zat terlarut tidak akan dapat berdifusi dari daerah yang lebih pekat ke daerah yang lebih encer. Sebaliknya, itu akan menjadi molekul air yang akan bergerak dari satu sisi ke sisi lain, melintasi penghalang semi-permeabel, dan osmosis terjadi. Dalam sistem berair dan biologis, penghalang ini adalah par excellence membran sel.
Memiliki penghalang semi-permeabel dan media pelarut, keberadaan ion atau garam terlarut di kedua media juga diperlukan: internal (di dalam penghalang), dan eksternal (di luar penghalang).
Jika konsentrasi ion-ion ini sama di kedua sisi, maka tidak akan ada kelebihan atau kekurangan molekul air untuk melarutkannya. Artinya, jumlah molekul air bebas adalah sama, dan oleh karena itu, mereka tidak akan melintasi penghalang semi-permeabel ke kedua sisi untuk menyamakan konsentrasi ion.
Persiapan
– Kondisi dan persamaan
Meskipun larutan isotonik dapat dibuat dengan pelarut apa pun, karena air adalah media untuk sel, ini dianggap sebagai pilihan yang lebih disukai. Dengan mengetahui secara pasti konsentrasi garam dalam organ tubuh tertentu, atau dalam aliran darah, adalah mungkin untuk memperkirakan berapa banyak garam yang harus dilarutkan dalam volume tertentu .
Pada organisme vertebrata , diterima bahwa rata-rata konsentrasi zat terlarut dalam plasma darah adalah sekitar 300 mOsm / L (miliosmolaritas), yang dapat diartikan hampir 300 mmol / L. Dengan kata lain, ini adalah konsentrasi yang sangat encer. Untuk memperkirakan miliosmolaritas, persamaan berikut harus diterapkan:
Osmolaritas = m v g
Untuk tujuan praktis diasumsikan bahwa g , koefisien osmotik, memiliki nilai 1. Jadi persamaannya sekarang terlihat seperti:
Osmolaritas = mv
Dimana m adalah molaritas zat terlarut, dan v adalah jumlah partikel di mana zat terlarut tersebut berdisosiasi dalam air. Kita kemudian mengalikan nilai ini dengan 1.000 untuk mendapatkan miliosmolaritas untuk zat terlarut tertentu.
Jika ada lebih dari satu zat terlarut, miliosmolaritas total larutan akan menjadi jumlah miliosmolaritas untuk setiap zat terlarut. Semakin banyak zat terlarut sehubungan dengan bagian dalam sel, semakin sedikit isotonik larutan yang disiapkan.
– Contoh persiapan
Misalkan Anda ingin menyiapkan satu liter larutan isotonik mulai dari glukosa dan natrium diacid fosfat. Berapa banyak glukosa yang harus Anda timbang? Asumsikan 15 gram NaH 2 PO 4 akan digunakan .
Langkah pertama
Pertama-tama kita harus menentukan osmolaritas NaH 2 PO 4 dengan menghitung molaritasnya. Untuk melakukan ini, kita beralih ke massa molar atau berat molekulnya , 120 g / mol. Karena kita diminta untuk satu liter larutan, kita menentukan mol dan kita akan memiliki molaritas secara langsung:
mol (NaH 2 PO 4 ) = 15 g 120g / mol
= 0,125 mol
M (NaH 2 PO 4 ) = 0,125 mol / L
Tetapi ketika NaH 2 PO 4 dilarutkan dalam air, ia melepaskan kation Na + dan anion H 2 PO 4 – , sehingga v memiliki nilai 2 dalam persamaan osmolaritas. Kita kemudian melanjutkan untuk menghitung NaH 2 PO 4 :
Osmolaritas = mv
= 0,125 mol / L 2
= 0,25 Osm / L
Dan ketika dikalikan dengan 1.000 kita mendapatkan miliosmolaritas dari NaH 2 PO 4 :
0,25 Osm / L 1.000 = 250 mOsm / L
Tahap kedua
Karena total miliosmolaritas larutan harus sama dengan 300 mOsm / L, kita kurangi untuk mengetahui berapa seharusnya glukosa:
mOsm / L (glukosa) = mOsm / L (Total) – mOsm / L (NaH 2 PO 4 )
= 300 mOsm / L – 250 mOsm / L
= 50 mOsm / L
Karena glukosa tidak terdisosiasi, v sama dengan 1 dan osmolaritasnya sama dengan molaritasnya:
M (glukosa) = 50 mOsm / L 1.000
= 0,05 mol / L
Menjadi molar glukosa 180 g / mol, akhirnya kita menentukan berapa gram yang harus kita timbang untuk melarutkannya dalam liter larutan isotonik itu:
Massa (glukosa) = 0,05 mol 180 g / mol
= 9 gram
Oleh karena itu, larutan isotonik NaH 2 PO 4 / glukosa ini dibuat dengan melarutkan 15 gram NaH 2 PO 4 dan 9 gram glukosa dalam satu liter air.
Contoh larutan isotonik
Larutan atau cairan isotonik tidak menyebabkan gradien atau perubahan konsentrasi ion dalam tubuh, sehingga tindakan mereka pada dasarnya difokuskan untuk menghidrasi pasien yang menerimanya jika terjadi perdarahan atau dehidrasi.
garam normal
Salah satu larutan tersebut adalah normal saline, dengan konsentrasi NaCl 0,9%.
Solusi Ringer Laktat
Larutan isotonik lain yang digunakan untuk tujuan yang sama adalah Ringer Laktat, yang menurunkan keasaman karena komposisi penyangga atau penyangganya, dan larutan fosfat Sorensen, yang terdiri dari fosfat dan natrium klorida.
Sistem tidak berair
Isotonisitas juga dapat diterapkan pada sistem non-air, seperti yang pelarutnya adalah alkohol; selama ada penghalang semi-permeabel yang mendukung penetrasi molekul alkohol dan mempertahankan partikel zat terlarut.
Referensi
- De Lehr Spilva, A. dan Muktans, Y. (1999). Panduan Spesialisasi Farmasi di Venezuela . Edisi XXXV. Edisi Global.
- Whitten, Davis, Peck & Stanley. (2008). Kimia . (edisi ke-8). CENGAGE Belajar.
- Elsevier BV (2020). larutan isotonik. Diperoleh dari: sciencedirect.com
- Adrian Brundage. (2020). Solusi Isotonik: Definisi & Contoh. Belajar. Diperoleh dari: study.com
- Felicitas Merino de la Hoz. (sf). Terapi cairan intravena. Universitas cantabria. [PDF]. Dipulihkan dari: ocw.unican.es
- Laboratorium Farmasi dan Peracikan. (2020). Sediaan Oftalmik: Buffer Isotonik. Dipulihkan dari: pharmlabs.unc.edu

