Apa itu imunoglobulin M?
immunoglobulin M atau IgM adalah antibodi yang diproduksi oleh sel B atau limfosit dari sistem kekebalan tubuh dari banyak hewan. Ini dapat ditemukan melekat pada membran plasma sel-sel ini atau dapat disekresikan sebagai kompleks ke dalam aliran darah dan getah bening, sehingga secara aktif berpartisipasi dalam proses imunitas humoral atau adaptif.
Seperti imunoglobulin lainnya (IgG, IgA, IgD dan IgE), imunoglobulin M memiliki struktur sedemikian rupa sehingga mampu mengikat hampir semua jenis antigen, termasuk protein, glikoprotein, polisakarida dan karbohidrat lainnya, asam nukleat, lipid, antara lain.
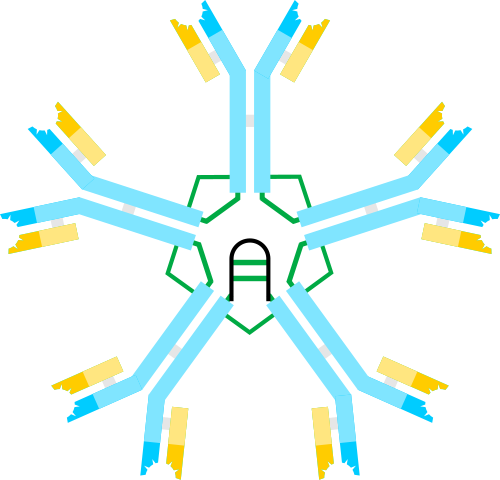
Skema imunoglobulin M, pentamer. Penulis: Artur Jan Fijałkowski, wikimedia commons
IgM adalah salah satu antibodi pertama yang diproduksi selama infeksi bakteri dan selama perkembangan neonatal.
Itu adalah yang pertama dimurnikan dengan homogenitas yang signifikan dan karena merupakan antibodi polireaktif, yaitu, ia memiliki kemampuan untuk mengikat dua atau lebih antigen secara bersamaan bahkan jika mereka berbeda sifatnya, sangat penting untuk memerangi patologi yang berbeda.
Sebagai “antibodi alami”, yaitu, yang diproduksi tanpa imunisasi sebelumnya yang disengaja, imunoglobulin ini dapat mengikat tidak hanya antigen bakteri, tetapi juga virus, protozoa, parasit metazoan, dan jamur, serta komponen tertentu dari plasma darah.
Struktur IgM
Analog dengan apa yang telah dijelaskan untuk imunoglobulin G, salah satu antibodi yang paling melimpah dalam plasma darah, dan imunoglobulin lainnya, monomer imunoglobulin M memiliki struktur yang dapat digambarkan sebagai bentuk “Y”, meskipun Antibodi ini biasanya ditemukan dalam plasma sebagai pentamer.
Masing-masing dari 5 subunit glikoprotein pentamerik ini terdiri dari empat rantai: dua rantai berat identik 55 kDa “μ” dan dua rantai ringan identik 25 kDa yang, bila dikaitkan dalam bentuk pentamerik terlarut, beratnya sekitar 970 kDa.
Rantai ringan hanya mengikat sebagian rantai berat melalui pembentukan jembatan disulfida antara residu sistein.
Ketika molekul-molekul ini dihidrolisis secara enzimatis, reaksi ini menghasilkan dua fragmen, salah satunya “homogen”, yang dikenal sebagai daerah konstan atau Fc, dan yang lainnya dikenal sebagai daerah variabel atau Fab2 (juga disebut daerah hipervariabel), yang mampu mengikat sebuah antigen.
Model skema IgM. Sumber: Marc Shulman, CC BY-SA 4.0 <https://creativecommons.org/licenses/ by-sa / 4.0>, melalui Wikimedia Commons
Urutan asam amino rantai berat imunoglobulin M, terutama pada daerah konstan, adalah yang menentukan identitasnya, serta isotipe antibodi lain yang telah ditentukan pada hewan, yang bersama-sama membentuk imunoglobulin superfamili.
Struktur tersier dari rantai berat dan ringan dari antibodi ini terdiri dari lembaran -lipat yang terhubung satu sama lain melalui loop dengan panjang yang bervariasi yang dapat distabilkan oleh jembatan disulfida.
Dalam bentuk pentamerik, setiap monomer IgM berinteraksi dengan rantai penyatuan polipeptida yang disebut rantai J, dari 15 kDa dan yang memungkinkan pembentukan struktur yang dibentuk oleh 5 monomer.
Karena setiap monomer memiliki kemampuan untuk mengikat dua molekul antigenik yang identik, pentamer IgM dapat mengikat 10 antigen secara bersamaan.
Fitur
Imunoglobulin M berpartisipasi dalam respon awal terhadap antigen bakteri, sehingga biasanya antibodi pertama yang disekresikan oleh sel B yang diaktifkan selama respon imun.
Karena strukturnya yang larut mampu mengikat sejumlah besar molekul antigen, ia memiliki kemampuan untuk mengagregasi atau mengaglutinasi partikel antigen milik sel seperti sel darah merah, bakteri, protozoa dan lain-lain.
Antibodi ini sangat penting untuk netralisasi awal toksin bakteri dan juga efektif dalam memediasi aktivitas sistem komplemen, mendorong “opsonisasi” partikel antigenik yang cepat.
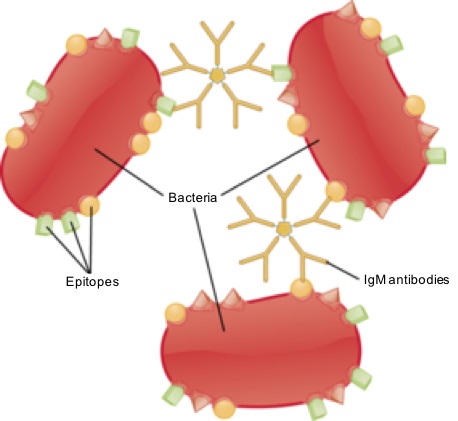
Representasi grafis dari imunoglobulin M yang terikat pada epitop antigenik bakteri invasif (Sumber: SA1590 [CC BY-SA (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Bentuk monomernya umumnya ditemukan melekat pada membran plasma limfosit B “naif”, seperti halnya dengan imunoglobulin D, dan telah ditentukan bahwa sebagian besar repertoar sel B neonatus sesuai dengan limfosit dengan IgM di dalamnya. membran. .
Juga patut dicatat adalah fakta bahwa itu adalah imunoglobulin pertama yang diproduksi oleh sel B “naif” pada janin selama kehamilan, setelah stimulasi antigenik pertama.
Meskipun dalam konsentrasi rendah, imunoglobulin M telah ditemukan dalam sekresi hewan mamalia, sebuah fakta yang menunjukkan bahwa itu juga berpartisipasi dalam perlindungan imunologi mukosa tubuh.
Nilai IgM yang tinggi (signifikan)
Seseorang dianggap memiliki kadar imunoglobulin tinggi ketika penelitian menunjukkan nilai di atas kisaran normal.
Nilai imunoglobulin M plasma yang tinggi mungkin menunjukkan paparan antigen baru-baru ini, serta tahap awal hepatitis virus dan kondisi patologis lainnya seperti:
– mononukleosis,
– radang sendi,
– Makroglobulinemia Waldenstrom,
– Sindrom nefrotik (kerusakan ginjal)
– Perkembangan infeksi yang disebabkan oleh agen parasit
Alasan lain mengapa dapat diperoleh nilai IgM serum yang tinggi adalah adanya sindrom “Hyper IgM” (HIGM). Pasien dengan sindrom ini lebih rentan terhadap infeksi berulang dan bahkan berbagai jenis kanker, karena menyebabkan penurunan drastis kadar IgG.
Nilai rendah (artinya)
Adanya beberapa patologi signifikan seperti multiple myeloma, beberapa jenis leukemia dan penyakit imunologi bawaan tertentu telah berkorelasi dengan rendahnya kadar imunoglobulin M dalam serum.
Pasien dengan sindrom defisiensi terkait-X Wiskott-Aldrich mungkin memiliki kadar IgM yang rendah, namun, sedikit peningkatan kadar empat imunoglobulin lainnya dapat mengkompensasi kondisi tersebut.
Tingkat IgM yang rendah dapat menunjukkan kondisi yang lebih parah seperti defisiensi imunoglobulin, yang dapat memiliki implikasi kesehatan yang serius, terutama selama paparan antigen baru atau selama perjalanan penyakit tertentu.
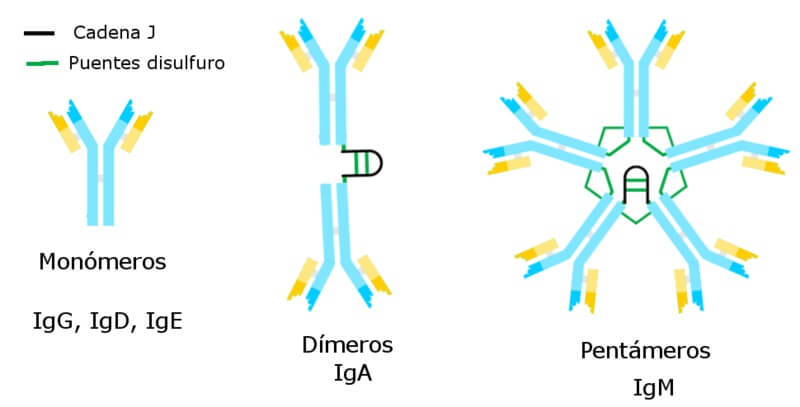
Jenis imunoglobulin. Sumber: Alejandro Porto, CC BY-SA 3.0 <https://creativecommons.org/licenses/by-sa/3.0>, melalui Wikimedia Commons
Kekurangan ini dapat memiliki banyak penyebab, dari kesalahan dalam sistem pengenalan antigen hingga cacat dalam produksi antibodi oleh limfosit B.
Tingkat serendah 40 mg / dL telah dilaporkan untuk pasien dengan defisiensi IgM selektif, yang terdiri dari bentuk disgammaglobulinemia yang “jarang”.
Nilai normal
Kisaran normal konsentrasi imunoglobulin M plasma sangat bervariasi dan tergantung, di antara banyak hal, pada usia. Menurut kelompok usia yang berbeda, antibodi ini berada dalam konsentrasi:
– 26-122 mg / dL antara 0 dan 5 bulan
– 32-132 mg / dL antara 5 dan 9 bulan
– 40-143 mg / dL antara 9 dan 15 bulan
– 46-152 mg / dL antara 15 dan 24 bulan
– 37-184 mg / dL antara 2 dan 4 tahun
– 27-224 mg / dL antara 4 dan 7 tahun
– 35-251 mg / dL antara 7 dan 10 tahun
– 41-255 mg / dL antara 10 dan 13 tahun
– 45-244 mg / dL antara 13 dan 16 tahun
– 49-201 mg / dL antara 16 dan 18 tahun
– 37-286 mg / dL pada orang dewasa di atas 18 tahun, meskipun beberapa teks menunjukkan bahwa kisarannya antara 45 dan 150 mg / dL, antara 45 dan 250 mg / dL atau antara 60 dan 360 mg / dL
Penting untuk disebutkan bahwa nilai konsentrasi IgM ini kurang lebih 10 kali lebih rendah daripada imunoglobulin penting lainnya seperti IgG, misalnya.

