cyclooxygenases (Coxs), juga dikenal sebagai Prostaglandin H Sintase atau Sintase prostaglandin endoperoxide, oxygenases adalah enzim milik asam lemak Myeloperoxidase superfamili dan ditemukan di semua hewan vertebrata .
Siklooksigenase adalah enzim bifungsional, karena mereka memiliki dua aktivitas katalitik yang berbeda: aktivitas siklooksigenase dan peroksidase, yang memungkinkan mereka mengkatalisis bis- oksigenasi dan reduksi asam arakidonat untuk membentuk prostaglandin.
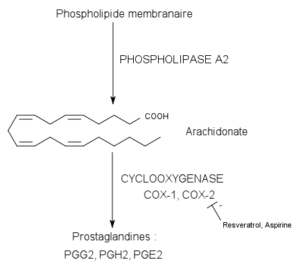
Reaksi yang dikatalisis oleh enzim siklooksigenase (Sumber: Pancrat [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] melalui Wikimedia Commons)
Mereka belum ditemukan pada tumbuhan , serangga atau organisme uniseluler, tetapi dalam sel vertebrata enzim ini terletak terutama di membran retikulum endoplasma, dengan laporan kehadiran mereka dalam amplop nuklir, badan lipid, mitokondria, struktur filamen. , vesikel. , dll.
Deteksi pertama dari produk yang disintesis oleh siklooksigenase dilakukan dalam cairan mani, itulah sebabnya awalnya dianggap bahwa mereka adalah zat yang diproduksi di prostat, itulah sebabnya mereka disebut “prostaglandin”.
Hari ini diketahui bahwa prostaglandin disintesis di semua jaringan hewan vertebrata dan bahkan dalam organisme yang tidak memiliki kelenjar prostat, dan bahwa isomer yang berbeda dari molekul ini memiliki fungsi yang berbeda dalam proses fisiologis dan patologis yang berbeda seperti demam, kepekaan terhadap rasa sakit atau algesia, inflamasi, trombosis, mitogenesis, vasodilatasi dan vasokonstriksi, ovulasi. fungsi ginjal, dll.
Indeks artikel
Jenis
Keberadaan dua jenis siklooksigenase telah dilaporkan di antara hewan vertebrata. Yang pertama ditemukan dan dimurnikan dikenal sebagai COX-1 atau hanya COX, dan pertama kali dimurnikan pada tahun 1976 dari vesikula seminalis domba dan sapi.
Siklooksigenase kedua yang ditemukan di antara eukariota adalah COX-2 pada tahun 1991. Sampai saat ini, semua hewan vertebrata, termasuk ikan bertulang rawan, ikan bertulang, burung, dan mamalia, telah terbukti memiliki dua gen yang mengkode enzim.
Salah satunya, COX-1 , mengkode siklooksigenase 1, yang bersifat konstitutif, sedangkan gen COX-2 mengkode siklooksigenase 2.
Karakteristik gen dan produk enzimnya
Enzim COX-1 dan COX-2 sangat mirip, yang dipahami sebagai 60-65% kesamaan antara urutan asam amino mereka.
orthologous COX-1 gen (gen dalam spesies yang berbeda yang memiliki asal yang sama) di semua spesies hewan vertebrata menghasilkan COX-1 protein yang saham sampai 95% dari identitas sekuens asam amino mereka, yang juga berlaku untuk orthologs dari COX-2 , produk yang berbagi 70-90% identitas.
Cnidaria dan sea squirt juga memiliki dua gen COX , tetapi ini berbeda dari hewan lain, sehingga beberapa penulis berhipotesis bahwa gen ini dapat muncul dalam peristiwa duplikasi independen dari nenek moyang yang sama.
COX-1
COX- 1 gen beratnya sekitar 22 kb dan konstitutif untuk mengkodekan COX-1 protein, yang telah lebih atau kurang 600 amino residu asam sebelum diproses, karena memiliki peptida sinyal hidrofobik setelah yang penghapusan itu menghasilkan protein sekitar 576 asam amino.
Protein ini terutama terdapat di retikulum endoplasma dan struktur umumnya berupa homodimer, yaitu dua rantai polipeptida identik yang berasosiasi membentuk protein aktif.
COX-2
Gen COX -2 , di sisi lain, beratnya sekitar 8 kb dan ekspresinya diinduksi oleh sitokin, faktor pertumbuhan, dan zat lainnya. Ini mengkode enzim COX-2 yang memiliki, termasuk peptida sinyal, 604 residu asam amino dan 581 setelah diproses.
Enzim ini juga homodimerik dan ditemukan di antara retikulum endoplasma dan selubung nukleus.
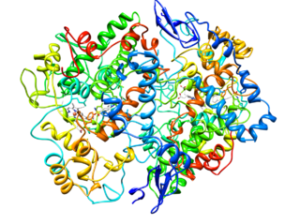
Struktur molekul siklooksigenase tipe 2 (COX-2) (Sumber: Cytochrome c di Wikipedia bahasa Inggris [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] melalui Wikimedia Commons)
Dari analisis strukturnya, telah ditentukan bahwa enzim COX-1 dan COX-2 memiliki di ujung N-terminalnya dan di situs yang berdekatan dengan peptida sinyal, “modul” unik faktor pertumbuhan epidermal (EGF, dari Faktor Pertumbuhan Epidermal Inggris ).
Dalam modul ini terdapat ikatan atau jembatan disulfida yang sangat terkonservasi, yang berfungsi sebagai “domain dimerisasi” antara dua polipeptida dari setiap enzim homodimer.
Protein juga memiliki heliks amfipatik yang memfasilitasi penahan ke salah satu lapisan membran. Selanjutnya, domain katalitik keduanya memiliki dua situs aktif, satu dengan aktivitas siklooksigenase dan yang lainnya dengan aktivitas peroksidase.
Kedua enzim adalah protein yang sangat terkonservasi, dengan sedikit perbedaan signifikan antara spesies yang berbeda mengenai mekanisme dimerisasi dan pengikatan membran, serta beberapa karakteristik domain katalitiknya.
Protein COX juga memiliki situs glikosilasi yang penting untuk fungsinya dan yang benar-benar dilestarikan.
Reaksi
Enzim siklooksigenase 1 dan 2 bertanggung jawab untuk mengkatalisis dua langkah pertama biosintesis prostaglandin, yang dimulai dengan konversi asam arakidonat menjadi prekursor prostaglandin yang dikenal sebagai hidroperoksi-endoperoksida PGG2.
Agar enzim ini dapat menjalankan fungsinya, mereka harus terlebih dahulu diaktifkan melalui proses yang bergantung pada aktivitas peroksidasenya. Dengan kata lain, aktivitas utamanya bergantung pada reduksi substrat peroksida (dimediasi oleh situs aktif peroksidase) untuk terjadinya oksidasi besi yang berasosiasi dengan gugus heme yang berfungsi sebagai kofaktor.
Oksidasi gugus heme menyebabkan pembentukan radikal tirosin di situs aktif siklooksigenase, yang mengaktifkan enzim dan mendorong inisiasi reaksi siklooksigenase. Reaksi aktivasi ini dapat terjadi hanya sekali, karena radikal tirosin diregenerasi selama reaksi terakhir di jalur tersebut.
Inhibitor
Siklooksigenase terlibat dalam sintesis prostaglandin, yang merupakan hormon yang berfungsi dalam perlindungan mukosa usus, dalam agregasi trombosit dan dalam pengaturan fungsi ginjal, selain berpartisipasi dalam proses peradangan, nyeri dan demam.
Mengingat bahwa enzim-enzim ini adalah kunci untuk produksi hormon-hormon ini, terutama yang berkaitan dengan proses inflamasi, banyak penelitian farmakologis telah difokuskan pada penghambatan siklooksigenase.
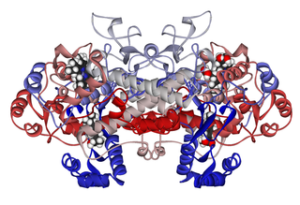
Struktur molekul siklooksigenase 1 terikat pada ibuprofen (Sumber: Fvasconcellos 5 Mei 2007 [Domain publik] melalui Wikimedia Commons)
Dengan demikian, mekanisme kerja banyak obat antiinflamasi nonsteroid telah terbukti berhubungan dengan asetilasi ireversibel atau reversibel (penghambatan) situs aktif siklooksigenase pada enzim ini.
Obat-obatan tersebut antara lain piroksikam, ibuprofen, aspirin, flurbiprofen, diklofenak, naproxen, dan lain-lain.
Referensi
- Botting, RM (2006). Inhibitor siklooksigenase: mekanisme, selektivitas dan kegunaan. Jurnal fisiologi dan farmakologi, 57, 113.
- Chandrasekharan, NV, & Simmons, DL (2004). Siklooksigenase. Biologi genom, 5 (9), 241.
- Fitzpatrick, FA (2004). Enzim siklooksigenase: regulasi dan fungsi. Desain farmasi saat ini, 10 (6), 577-588.
- Kundu, N., Smyth, MJ, Samsel, L., & Fulton, AM (2002). Inhibitor siklooksigenase memblokir pertumbuhan sel, meningkatkan ceramide dan menghambat siklus sel. Penelitian dan pengobatan kanker payudara, 76 (1), 57-64.
- Rouzer, CA, & Marnett, LJ (2009). Siklooksigenase: wawasan struktural dan fungsional. Jurnal penelitian lipid, 50 (Suplemen), S29-S34.
- Vane, JR, Bakhle, YS, & Botting, RM (1998). CYCLOOXYGENASES 1 DAN 2. Tinjauan tahunan farmakologi dan toksikologi, 38 (1), 97-120.

