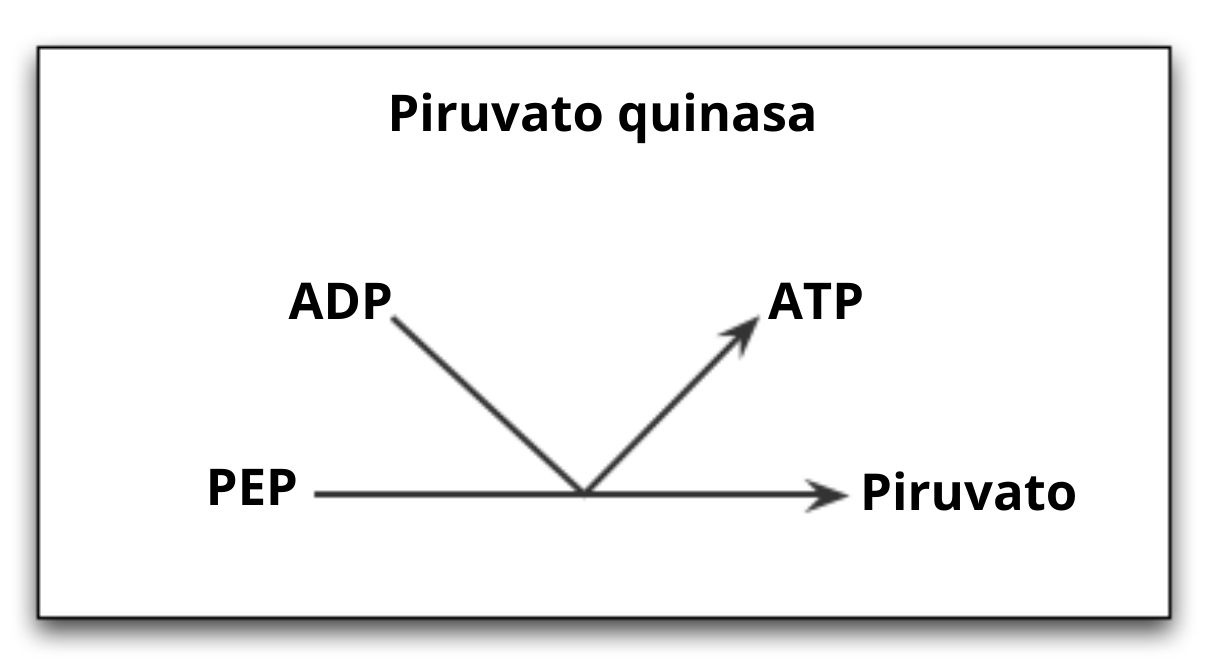
Reaksi yang dikatalisis oleh enzim piruvat kinase
Apa itu piruvat kinase?
piruvat kinase ( Pyk ) adalah enzim yang mengkatalisis langkah terakhir dalam jalur glikolitik, yang melibatkan transfer ireversibel dari kelompok fosfat dari satu molekul phosphoenolpyruvate (PEP) untuk sebuah molekul ADP, yang mengakibatkan sintesis dari molekul ATP dan asam piruvat atau piruvat lainnya.
Piruvat yang dihasilkan selanjutnya berpartisipasi dalam berbagai jalur katabolik dan anabolik (biosintetik): dapat didekarboksilasi untuk menghasilkan asetil-KoA, dikarboksilasi untuk menghasilkan oksaloasetat, ditransaminasi untuk menghasilkan alanin, dioksidasi untuk menghasilkan asam laktat atau dapat diarahkan ke glukoneogenesis untuk sintesis glukosa.
Karena berpartisipasi dalam glikolisis, enzim ini sangat penting untuk metabolisme karbohidrat banyak organisme, uniseluler dan multiseluler, yang menggunakan ini sebagai jalur katabolik utama untuk memperoleh energi.
Contoh sel yang sangat bergantung pada glikolisis untuk energi adalah sel eritrosit mamalia, di mana defisiensi salah satu enzim yang terlibat dalam jalur ini dapat memiliki efek yang sangat negatif.
Struktur piruvat kinase
Empat isoform enzim piruvat kinase telah dijelaskan pada mamalia:
– PKM1 , khas di otot
– PKM2 , hanya pada janin (kedua produk dari pemrosesan alternatif RNA messenger yang sama)
– PKL , hadir di hati dan
– PKR , hadir dalam eritrosit (keduanya dikodekan oleh gen yang sama, PKLR , tetapi ditranskripsi oleh promotor yang berbeda).
Namun, analisis yang dilakukan pada struktur enzim piruvat kinase yang berbeda di alam (termasuk 4 enzim ini dari mamalia) menunjukkan kesamaan besar dalam struktur umum, serta sehubungan dengan arsitektur situs aktif dan mekanisme pengaturan.
Secara umum, ini adalah enzim dengan berat molekul 200 kDa , yang dicirikan oleh struktur tetramerik yang terdiri dari 4 unit protein yang identik, kurang lebih 50 atau 60 kDa, dan masing-masing dengan 4 domain, yaitu:
– Domain heliks kecil di N-terminus (tidak ada dalam enzim bakteri)
– Domain “ A ”, diidentifikasi dengan topologi 8 lembar terlipat dan 8 heliks
– Domain A ” B ” , disisipkan di antara lembar beta terlipat nomor 3 dan alfa heliks nomor 3 dari domain “A”
– Domain A ” C ” , yang memiliki topologi +
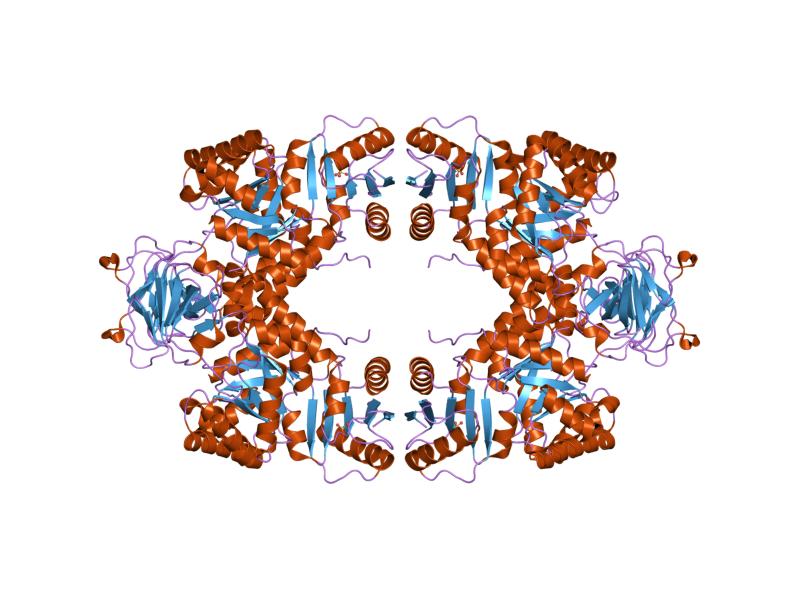
Struktur molekul enzim piruvat kinase
Tiga situs telah terdeteksi dalam tetramer piruvat kinase dari organisme yang berbeda: situs aktif, situs efektor, dan situs pengikatan asam amino. Situs aktif enzim ini terletak di antara domain A dan B, di sekitar “situs efektor”, yang termasuk dalam domain C.
Dalam tetramer, domain C membentuk antarmuka “kecil”, sedangkan domain A membentuk antarmuka yang lebih besar.
Fungsi piruvat kinase
Seperti yang telah dibahas, piruvat kinase mengkatalisis langkah terakhir dari jalur glikolitik, yaitu transfer gugus fosfat dari fosfoenolpiruvat (PEP) ke molekul ADP untuk menghasilkan ATP dan molekul asam piruvat atau piruvat.
Produk dari reaksi yang dikatalisis oleh enzim ini sangat penting untuk konteks metabolisme yang berbeda. Piruvat dapat digunakan dengan berbagai cara:
- Dalam kondisi aerobik, yaitu, dengan adanya oksigen, dapat digunakan sebagai substrat untuk enzim yang dikenal sebagai kompleks piruvat dehidrogenase, untuk didekarboksilasi dan diubah menjadi asetil-KoA, molekul yang dapat memasuki siklus Krebs di mitokondria atau berpartisipasi dalam jalur anabolik lain seperti biosintesis asam lemak, misalnya.
- Dengan tidak adanya oksigen atau anaerobiosis, piruvat dapat digunakan oleh enzim laktat dehidrogenase untuk menghasilkan asam laktat (oksidasi) melalui proses yang dikenal sebagai “fermentasi laktat.”
- Selanjutnya, piruvat dapat diubah menjadi glukosa oleh glukoneogenesis, menjadi alanin oleh alanin transaminase, menjadi oksaloasetat oleh piruvat karboksilase, dll.
Penting untuk diingat bahwa dalam reaksi yang dikatalisis oleh enzim ini, sintesis bersih ATP juga terjadi, yang menyebabkan glikolisis, menghasilkan 2 molekul piruvat dan 2 molekul ATP untuk setiap molekul glukosa.
Jadi, dari perspektif ini, enzim piruvat kinase memainkan peran mendasar dalam banyak aspek metabolisme sel, sedemikian rupa sehingga digunakan sebagai target terapi untuk banyak patogen manusia, di antaranya berbagai protozoa menonjol.
Peraturan
Piruvat kinase adalah enzim yang sangat penting dari sudut pandang metabolisme sel, karena merupakan salah satu yang membentuk senyawa terakhir yang dihasilkan dari jalur katabolisme glukosa: piruvat.
Selain menjadi salah satu dari tiga enzim yang paling diatur di seluruh jalur glikolitik (dua lainnya adalah heksokinase (HK) dan fosfofruktokinase (PFK)), piruvat kinase adalah enzim yang sangat penting untuk mengontrol aliran metabolisme dan produksi ATP melalui glikolisis.
Ini diaktifkan oleh fosfoenolpiruvat, salah satu substratnya (regulasi homotropik), serta oleh gula mono dan difosforilasi lainnya, meskipun regulasinya tergantung pada jenis isoenzim yang dipertimbangkan.
Beberapa teks ilmiah menunjukkan bahwa regulasi enzim ini juga bergantung pada arsitektur “multidomain”, karena aktivasinya tampaknya bergantung pada beberapa rotasi di domain subunit dan pada perubahan geometri situs aktif.
Untuk banyak organisme, aktivasi alosterik piruvat kinase bergantung pada fruktosa 1,6-bifosfat (F16BP), tetapi ini tidak berlaku untuk enzim tanaman. Enzim lain juga diaktifkan oleh AMP siklik dan glukosa 6-fosfat.
Lebih lanjut, telah ditunjukkan bahwa aktivitas sebagian besar piruvat kinase yang dipelajari sangat bergantung pada keberadaan ion monovalen seperti kalium (K +) dan ion divalen seperti magnesium (Mg + 2) dan mangan (Mn + 2) . ).
Inhibisi
Piruvat kinase terutama dihambat oleh efektor alosterik fisiologis, sehingga proses ini sangat bervariasi antara spesies yang berbeda dan bahkan antara jenis sel dan jaringan organisme yang sama.
Pada banyak mamalia, glukagon, epinefrin, dan cAMP memiliki efek penghambatan pada aktivitas piruvat kinase, efek yang dapat dilawan oleh insulin.
Selain itu, telah terbukti bahwa beberapa asam amino, seperti fenilalanin, dapat bertindak sebagai inhibitor kompetitif untuk enzim ini di otak.

