oksidoreduktase adalah protein dengan aktivitas enzimatik yang bertanggung jawab untuk katalisasi oksidasi – reduksi, yaitu, reaksi yang melibatkan penghapusan atom hidrogen atau elektron dalam substrat di mana mereka bertindak.
Reaksi yang dikatalisis oleh enzim-enzim ini, seperti namanya, adalah reaksi oksidasi-reduksi, yaitu reaksi di mana satu molekul menyumbangkan elektron atau atom hidrogen dan yang lain menerimanya, mengubah keadaan oksidasi masing-masing.
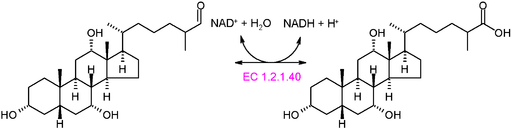
Skema grafik dari reaksi EC 1.2.1.40 tipe oksidoreduktase (Sumber: akane700 [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)] Via Wikimedia Commons)
Contoh enzim oksidoreduktase yang sangat umum di alam adalah dehidrogenase dan oksidase. Disebutkan dapat dibuat dari enzim alkohol dehidrogenase, yang mengkatalisis dehidrogenasi etanol untuk menghasilkan asetaldehida dengan cara yang tergantung NAD + atau reaksi sebaliknya, untuk menghasilkan etanol selama fermentasi alkohol yang dilakukan oleh beberapa ragi yang penting secara komersial.
Enzim rantai transpor elektron dalam sel aerobik adalah oksidoreduktase yang bertanggung jawab untuk memompa proton, itulah sebabnya mereka menghasilkan gradien elektrokimia melalui membran mitokondria internal yang memungkinkan sintesis ATP untuk dipromosikan.
Indeks artikel
Karakteristik umum
Enzim oksidoreduktase adalah enzim yang mengkatalisis oksidasi satu senyawa dan reduksi bersamaan yang lain.
Ini biasanya membutuhkan keberadaan berbagai jenis koenzim untuk operasinya. Koenzim memenuhi fungsi menyumbangkan atau menerima elektron dan atom hidrogen yang ditambahkan atau dihilangkan oleh oksidoreduktase ke substratnya.
Koenzim ini dapat berupa pasangan NAD+/NADH atau pasangan FAD/FADH2. Dalam banyak sistem metabolisme aerobik, elektron dan atom hidrogen ini akhirnya ditransfer dari koenzim yang terlibat ke oksigen.
Mereka adalah enzim dengan “kekurangan” spesifisitas substrat yang nyata, yang memungkinkan mereka untuk mengkatalisis reaksi ikatan silang dalam berbagai jenis polimer, apakah itu protein atau karbohidrat.
Klasifikasi
Sering kali, nomenklatur dan klasifikasi enzim ini didasarkan pada substrat utama yang mereka gunakan dan jenis koenzim yang mereka butuhkan untuk berfungsi.
Menurut rekomendasi Komite Nomenklatur Persatuan Internasional untuk Biokimia dan Biologi Molekuler (NC-IUBMB), enzim-enzim ini termasuk dalam kelas EC 1 dan mencakup kurang lebih 23 jenis yang berbeda (EC1.1-EC1.23), yaitu :
– EC 1.1: yang bekerja pada gugus CH-OH dari donor.
– EC 1.2: yang bekerja pada gugus aldehida atau gugus okso dari donor.
– EC 1.3: yang bekerja pada gugus CH-CH dari donor.
– EC 1.4: yang bekerja pada gugus CH-NH2 dari donor.
– EC 1.5: yang bekerja pada gugus CH-NH dari donor.
– EC 1.6: yang bertindak di NADH atau di NADPH.
– EC 1.7: yang bekerja pada senyawa nitrogen lain sebagai donor.
– EC 1.8: yang bekerja pada gugus belerang dari donor.
– EC 1.9: yang bertindak dalam kelompok heme donor.
– EC 1.10: yang bekerja pada donor seperti difenol dan zat terkait lainnya.
– EC 1.11: yang bekerja pada peroksida sebagai akseptor.
– EC 1.12: yang bekerja pada hidrogen sebagai donor.
– EC 1.13: yang bekerja pada donor sederhana dengan penggabungan molekul oksigen (oksigenase).
– EC 1.14: yang bekerja pada donor “berpasangan”, dengan penggabungan atau reduksi molekul oksigen.
– EC 1.15: yang bekerja pada superoksida sebagai akseptor.
– EC 1.16: yang mengoksidasi ion logam.
– EC 1.17: yang bekerja pada gugus CH atau CH2.
– EC 1.18: yang bekerja pada protein yang mengandung zat besi dan bertindak sebagai donor.
– EC 1.19: yang bekerja pada flavodoxin tereduksi sebagai donor.
– EC 1.20: yang bekerja pada donor seperti fosfor dan arsenik.
– EC 1.21: yang bertindak dalam reaksi XH + YH = XY.
– EC 1.22: yang bekerja pada halogen donor.
– EC 1.23: yang mereduksi gugus COC sebagai akseptor.
– EC 1.97: oksidoreduktase lainnya.
Masing-masing kategori ini selanjutnya mencakup subkelompok di mana enzim dipisahkan sesuai dengan preferensi substrat.
Misalnya, dalam kelompok oksidoreduktase yang bekerja pada gugus CH-OH dari donornya, ada beberapa yang lebih memilih NAD + atau NADP + sebagai akseptor, sementara yang lain menggunakan sitokrom, oksigen, belerang, dll.
Struktur
Karena kelompok oksidoreduktase sangat beragam, menetapkan karakteristik struktural yang ditentukan cukup sulit. Strukturnya tidak hanya bervariasi dari enzim ke enzim, tetapi juga antara spesies atau kelompok makhluk hidup dan bahkan dari sel ke sel dalam jaringan yang berbeda.
Model bioinformatika dari struktur enzim oksidoreduktase (Sumber: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik] Via Wikimedia Commons)
Enzim piruvat dehidrogenase, misalnya, adalah kompleks yang terdiri dari tiga subunit katalitik yang terhubung secara berurutan yang dikenal sebagai subunit E1 (piruvat dehidrogenase), subunit E2 (dihydrolipoamide acetyltransferase) dan subunit E3 (dihydrolipoamide dehydrogenase).
Masing-masing subunit ini, pada gilirannya, dapat terdiri dari lebih dari satu monomer protein dari jenis yang sama atau dari jenis yang berbeda, yaitu, mereka dapat menjadi homodimer (mereka yang hanya memiliki dua monomer yang sama), heterotrimerik (mereka yang memiliki tiga monomer). berbeda) dan sebagainya.
Namun, mereka biasanya merupakan enzim yang terdiri dari heliks alfa dan lembaran lipat yang disusun dengan cara yang berbeda, dengan interaksi intra dan antar molekul spesifik dari jenis yang berbeda.
Fitur
Enzim oksidoreduktase mengkatalisis reaksi oksidasi-reduksi di hampir semua sel semua makhluk hidup di biosfer. Reaksi-reaksi ini umumnya reversibel, di mana keadaan oksidasi satu atau lebih atom dalam molekul yang sama diubah.
Oksidoreduktase biasanya membutuhkan dua substrat, satu yang bertindak sebagai donor hidrogen atau elektron (yang dioksidasi) dan yang lain bertindak sebagai akseptor hidrogen atau elektron (yang direduksi).
Enzim ini sangat penting untuk banyak proses biologis dalam berbagai jenis sel dan organisme.
Mereka bekerja, misalnya, dalam sintesis melanin (pigmen yang terbentuk di sel kulit manusia), dalam pembentukan dan degradasi lignin (senyawa struktural sel tumbuhan), dalam protein lipat, dll.
Mereka digunakan secara industri untuk memodifikasi tekstur beberapa makanan dan contohnya adalah peroksidase, glukosa oksidase dan lainnya.
Selain itu, enzim yang paling menonjol dari kelompok ini adalah mereka yang berpartisipasi sebagai transporter elektronik dalam rantai transpor membran mitokondria, kloroplas dan membran plasma internal bakteri, di mana mereka adalah protein transmembran.
Contoh Oksidoreduktase
Ada ratusan contoh enzim oksidoreduktase di alam dan di industri. Enzim-enzim ini, seperti yang telah dibahas, memiliki fungsi yang sangat penting untuk fungsi sel dan, oleh karena itu, untuk kehidupan itu sendiri .
Oksidoreduktase tidak hanya mencakup enzim peroksidase, lakase, oksidase glukosa atau alkohol dehidrogenase; Mereka juga menggabungkan kompleks penting seperti enzim gliseraldehida 3-fosfat dehidrogenase atau kompleks piruvat dehidrogenase, dll, penting dari sudut pandang katabolisme glukosa.
Ini juga mencakup semua enzim kompleks transpor elektron di membran mitokondria bagian dalam atau di membran bagian dalam bakteri, mirip dengan beberapa enzim yang ditemukan di kloroplas organisme tumbuhan.
Peroksidase
Peroksidase adalah enzim yang sangat beragam dan menggunakan hidrogen peroksida sebagai akseptor elektron untuk mengkatalisis oksidasi berbagai substrat, termasuk fenol, amina atau tiol, antara lain. Dalam reaksi mereka, mereka mereduksi hidrogen peroksida untuk menghasilkan air.
Mereka sangat penting dari sudut pandang industri, dengan lobak peroksidase menjadi yang paling penting dan paling dipelajari dari semuanya.
Secara biologis, peroksidase penting untuk menghilangkan senyawa oksigen reaktif yang dapat menyebabkan kerusakan signifikan pada sel.
Referensi
- Ensiklopedia Britannica. (2019). Diakses pada 26 Desember 2019, dari www.britannica.com
- Ercili-Cura, D., Huppertz, T., & Kelly, AL (2015). Modifikasi enzimatik tekstur produk susu. Dalam Memodifikasi Tekstur Makanan (hlm. 71-97). Penerbitan Woodhead.
- Mathews, CK, Van Holde, KE, & Ahern, KG (2000). Biokimia. Menambahkan. Wesley Longman, San Fransisco.
- Nelson, DL, Lehninger, AL, & Cox, MM (2008). Prinsip biokimia Lehninger. Macmillan.
- Komite Nomenklatur Persatuan Internasional Biokimia dan Biologi Molekuler (NC-IUBMB). (2019). Diperoleh dari www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Patel, MS, Nemeria, NS, Furey, W., & Jordan, F. (2014). Kompleks piruvat dehidrogenase: fungsi dan regulasi berbasis struktur. Jurnal Kimia Biologi, 289 (24), 16615-16623.

