Rata – rata MIO adalah tes biokimia yang digunakan untuk membantu identifikasi spesies bakteri yang termasuk dalam famili Enterobacteriaceae. Ini cukup bergizi dan terdiri dari glukosa, ekstrak ragi, pepton, triptein, L-ornithine hidroklorida, bromocresol ungu, dan agar-agar.
Arti dari akronimnya (MIO) menggambarkan setiap parameter yang dapat diamati dalam media ini; motilitas, indol dan ornitin. Motilitas adalah kemampuan mikroorganisme untuk bergerak karena adanya flagela. Agar sifat ini dapat diamati, konsistensi medium harus semipadat, sehingga sediaan mengandung lebih sedikit agar.
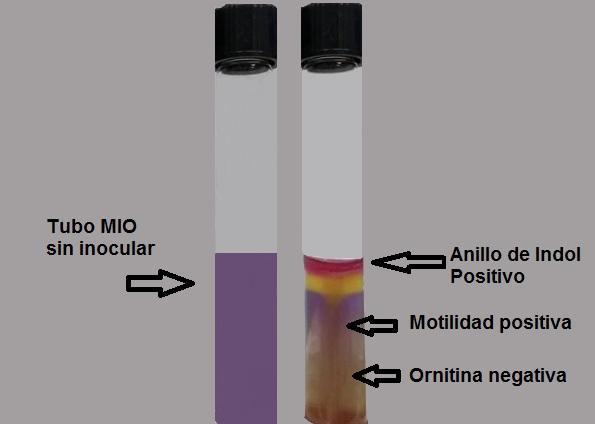
Garis besar interpretasi hasil dalam media MIO. Sumber: Disiapkan oleh penulis MSc. Marielsa Gil
Produksi indol menunjukkan adanya enzim triptofanase yang bekerja pada asam amino triptofan, membutuhkan penggunaan reagen pengungkap untuk membuat produksi indol terlihat.
Akhirnya, ornitin menentukan apakah bakteri mampu mendekarboksilasi asam amino, yaitu, jika ia memiliki enzim orinitin dekarboksilase.
Indeks artikel
Dasar
Peptone, ekstrak ragi dan triptein
Unsur-unsur ini berkontribusi pada kekuatan nutrisi media ini. Mereka berfungsi sebagai sumber nutrisi dan asam amino esensial untuk perkembangan bakteri.
Selain itu, triptein merupakan sumber triptofan untuk menunjukkan adanya enzim triptofanase, yang mendegradasi triptofan melalui deaminasi reduktif, melepaskan indol, asam piruvat, amonia dan energi.
Indole tidak berwarna, oleh karena itu keberadaannya diketahui dengan menambahkan lima tetes reagen Ehrlich atau Kovacs, keduanya dengan p-dimethylaminobenzaldehyde.
Gugus aldehida dari senyawa ini bereaksi dengan indol, menghasilkan produk berbentuk cincin berwarna merah fuchsia pada permukaan agar.
Setiap jejak warna harus dianggap sebagai tes positif. Buktinya harus segera dibaca, karena seiring waktu warnanya menurun.
Selanjutnya, tes ini harus diungkapkan setelah dekarboksilasi ornitin dan hasil motilitas telah dicatat.
Penafsiran
Uji positif: pembentukan cincin fuchsia merah saat menambahkan tetes reagen Kovacs.
Tes negatif: tidak ada pembentukan cincin.
Motilitas
Kemampuan bakteri untuk bergerak akan dibuktikan jika diamati media yang keruh atau jika ada garis pertumbuhan tebal yang meluas di sekitar inokulasi awal.
Tes motilitas negatif akan dibuktikan dengan mengamati garis tipis pertumbuhan, dan segala sesuatu di sekitarnya akan tanpa pertumbuhan.
Adalah penting bahwa motilitas dibaca sebelum indole terungkap, karena penambahan reagen mengaburkan seluruh media.
Pada bakteri yang bergerak tetapi tumbuh lambat, sulit untuk menunjukkan motilitasnya dengan media ini. Dalam hal ini, dianjurkan untuk menggunakan tes atau metode lain, seperti motilitas sedang atau metode drop-pending.
Glukosa
Glukosa adalah karbohidrat yang dapat difermentasi yang, selain menyediakan energi, mengasamkan lingkungan, suatu kondisi yang diperlukan untuk terjadinya dekarboksilasi asam amino ornitin.
fermentasi glukosa harus selalu terjadi, mulai dari prinsip bahwa semua bakteri milik Enterobacteriaceae glukosa fermentasi keluarga.
L-Ornithine
Jika bakteri menghasilkan enzim ornitin dekarboksilase, ia dapat bertindak setelah media diasamkan oleh fermentasi glukosa.
Enzim ornitin dekarboksilase bekerja pada gugus karboksil dari asam amino yang menghasilkan amina yang disebut putresin yang sekali lagi mengakali medium.
Tes ini harus dibaca setelah 24 jam inkubasi, karena jika Anda mencoba membaca sebelumnya, Anda dapat salah menafsirkan tes dengan negatif palsu.
Harus diingat bahwa reaksi pertama yang terjadi adalah fermentasi glukosa, itulah sebabnya media berubah menjadi kuning pada fase awal (10 hingga 12 jam pertama). Jika dekarboksilasi ornitin selanjutnya terjadi, media akan berubah menjadi ungu.
Penting untuk menginterpretasikan uji dekarboksilasi ornitin sebelum mengungkapkan indol, karena penambahan reagen Kovacs mengubah warna media.
Penafsiran
Uji negatif: medium dengan warna kuning atau dengan latar belakang kuning.
Tes positif: sedang benar-benar ungu.
indikator PH
Dalam hal ini, bromocresol ungu digunakan; yang bertugas mengungkapkan bila ada perubahan pH dalam medium. Pada pengasaman, indikator berubah menjadi kuning, dan pada alkalisasi, berubah menjadi ungu.
Teknik pembibitan dan pengembangan
Untuk menabur media MIO, loop lurus atau jarum digunakan dan dengan itu sebagian dari koloni yang akan dipelajari dikumpulkan.
Sebuah tusukan dalam dibuat di tengah MIO dalam garis lurus. Tidak disarankan untuk melakukan tusukan ganda, karena dapat memberikan gambaran motilitas yang salah jika tusukan tidak dilakukan di tempat yang sama.
Inkubasi selama 24 hingga 48 jam pada suhu 37 ° C dalam aerobiosis. Lihatlah hasil dalam urutan ini: motilitas, dekarboksilasi ornitin dan akhirnya mengungkapkan indole.
Disarankan untuk menghilangkan 2 ml media secara aseptik, memindahkannya ke tabung steril dan melakukan uji indol di sana, sehingga jika negatif, sisa tabung asli dapat diinkubasi selama 24 jam lagi, untuk mengungkapkan indo lagi.
Pengembangan indole dilakukan sebagai berikut: 3 sampai 5 tetes reagen Kovacs ditambahkan ke media MIO dan dikocok kuat-kuat. Diamati apakah cincin fuchsia merah muncul atau tidak.
Persiapan
MIO sedang
Timbang 31 g media MIO dan larutkan dalam satu liter air suling.
Panaskan sampai campuran mendidih selama satu menit, sering-sering dikocok sampai agar-agar benar-benar larut. Distribusikan 4 ml media ke dalam tabung reaksi 13/100 dengan tutup kapas.
Sterilkan dalam autoklaf pada suhu 121°C selama 15 menit. Keluarkan dari autoklaf dan biarkan berdiri tegak di rak, sehingga terbentuk balok setengah padat.
Simpan di lemari es 2-8°C. Biarkan hangat sebelum menabur strain bakteri.
Warna media yang dikeringkan adalah krem dan warna media yang disiapkan sedikit ungu opalescent.
PH akhir dari media yang disiapkan adalah 6,5 ± 0,2
Medium berubah menjadi kuning pada pH asam dan berwarna ungu pada pH basa.
Reagen Kovacs (Pengembang Uji Indole)
Reagen ini dibuat sebagai berikut:
150 ml amil, isoamil atau butil alkohol (salah satu dari ketiganya) diukur. 10 g p-dimethylaminobenzaldehyde dilarutkan di dalamnya. Kemudian 50 ml asam klorida pekat ditambahkan perlahan-lahan .
Reagen yang disiapkan tidak berwarna atau kuning muda. Itu harus disimpan dalam botol kuning dan disimpan di lemari es. Warna coklat tua menunjukkan kemerosotannya.
Juga reagen Kovacs dapat diganti dengan reagen Ehrlich. Yang terakhir, karena lebih sensitif, lebih disukai untuk mengungkapkan indol pada bakteri yang memproduksinya dalam jumlah kecil, seperti pada beberapa batang Gram negatif yang tidak memfermentasi dan anaerob tertentu.
Menggunakan
Media ini merupakan uji yang melengkapi serangkaian uji biokimia untuk identifikasi bakteri yang termasuk dalam famili Enterobacteriaceae.
Data dekarboksilasi ornitin berfungsi untuk membedakan Shigella sonnei, yang dites positif, dari Shigella boydii, Shigella flexneri, dan S. dysenterieae, yang dites negatif.
Ini juga membedakan genus Klebsiella, yang dites negatif, dari genus Enterobacter, di mana sebagian besar spesiesnya dites positif.
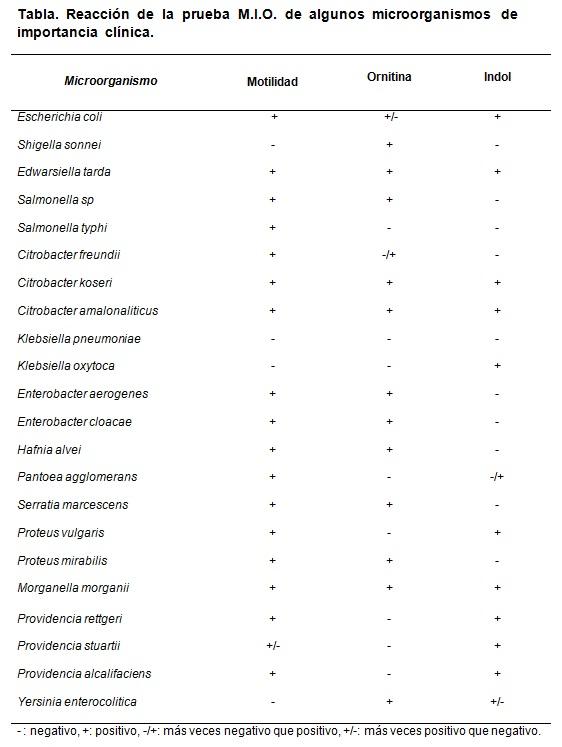
Sumber: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. edisi ke-5. Editorial Panamericana SA Argentina.
QA
Setiap kali batch media MIO disiapkan, tes kontrol dapat dilakukan. Untuk ini, strain yang dikenal atau bersertifikat digunakan untuk mengamati perilaku medium.
Strain yang dapat digunakan adalah Escherichia coli, Morganella morganii, Klebsiella pneumoniae, Enterobacter aerogenes dan Proteus mirabilis.
Hasil yang diharapkan adalah E. coli dan M. morganii. Dan M: +, I: + dan O: +.
Klebsiella pneumoniae semuanya negatif (M: -, I: -, O :-). Proteus mirabilis dan Enterobacter aerogenes memberikan M: + I: – dan O: +.
Referensi
- Mac Faddin J. (2003). Tes biokimia untuk identifikasi bakteri yang penting secara klinis. edisi ke-3 Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosa Mikrobiologi Bailey & Scott. 12 edisi Editorial Panamericana SA Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. edisi ke-5. Editorial Panamericana SA Argentina.
- Laboratorium Britannia. MIO Medio 2015.Tersedia di: britanialab.com
- Laboratorium BD. BBL Motility Indole Ornithine (MIO) Medium. 2007. Tersedia di: bd.com
- Laboratorium Valtek. Medium MIO Motilitas, Indole, Ornithine. 2010.Tersedia di: andinamedica.com

