LIA agar (Lysine Iron) adalah uji biokimia digunakan untuk mengidentifikasi bakteri dari keluarga Enterobacteriaceae . Media ini dibuat oleh Edwards dan Fife, berdasarkan rumus Falkow.
Awalnya tes ini adalah kaldu yang mengandung pepton, ekstrak ragi, glukosa, L-lisin, bromocresol ungu, dan air suling . Edwards dan Fife menambahkan agar-agar, besi amonium sitrat, dan natrium tiosulfat.
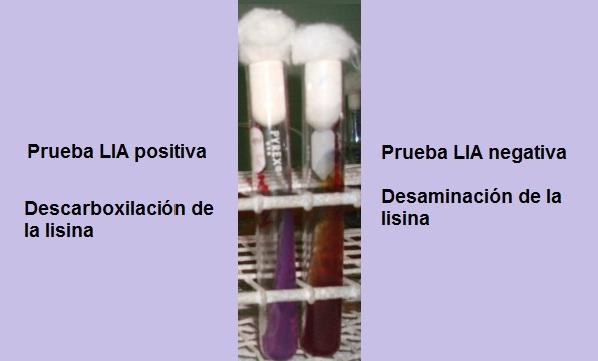
Tes positif dan negatif untuk dekarboksilasi lisin. Sumber: Foto dan diagram milik penulis MSc. Marielsa Gil
Tes pada dasarnya terdiri dari menunjukkan adanya enzim lisin dekarboksilase, mampu bereaksi dengan gugus karboksil dari asam amino L-lisin. Deaminasi asam amino juga dapat terjadi karena adanya enzim lisin deaminase.
Selain itu, komposisi media memungkinkan bukti kemampuan beberapa genera bakteri untuk menghasilkan hidrogen sulfida. Akhirnya, dimungkinkan juga untuk mengamati timbulnya atau tidaknya gas dalam medium.
Indeks artikel
Dasar
Pepton dan ekstrak ragi
Seperti kebanyakan media kultur , agar besi lisin mengandung komponen yang menyediakan sumber nutrisi yang diperlukan untuk pertumbuhan bakteri. Komponen ini diwakili oleh pepton dan ekstrak ragi.
Glukosa
Demikian juga agar-agar ini mengandung glukosa sebagai karbohidrat yang dapat difermentasi. Semua bakteri dalam keluarga Enterobacteriaceae diketahui memfermentasi glukosa.
Langkah ini sangat penting, karena akan bertanggung jawab untuk mengasamkan media, kondisi penting untuk enzim lisin dekarboksilase -jika ada- untuk bekerja pada substratnya.
Pada beberapa genera bakteri, produksi gas akibat fermentasi glukosa dapat diamati .
Gas dibuktikan ketika ada perpindahan agar-agar di dalam tabung, meninggalkan ruang kosong di bagian bawah tabung, atau dengan memecah media menjadi dua bagian atau lebih.
L-lisin
Setelah lisin didekarboksilasi, diamina (kadaverin) dan karbon dioksida terbentuk.
Dekarboksilasi terjadi dengan adanya koenzim piridoksal fosfat. Reaksi ini tidak dapat diubah.
Indikator PH (bromocresol ungu)
Semua perubahan pH yang terjadi dalam medium akibat berbagai reaksi dideteksi oleh indikator pH bromocresol ungu.
Dalam pengertian ini, ketika ada pengasaman, media berubah menjadi kuning, dan ketika ada alkalinisasi, media kembali ke warna ungu atau ungu aslinya.
Ketika deaminasi lisin terjadi karena adanya enzim lisin deaminase, warna kemerahan terbentuk di permukaan, khas pada genera Proteus, Providencia, dan beberapa spesies Morganella.
Ini disebabkan oleh fakta bahwa selama proses deaminasi terbentuk asam alfa-keto-karbonat, yang bereaksi dengan amonium sitrat dengan adanya oksigen, menyebabkan warna yang disebutkan di atas.
Ferric Amonium Sitrat dan Sodium Thiosulfate
Sebaliknya bakteri penghasil hidrogen sulfida akan dibuktikan dengan adanya natrium tiosulfat (sumber belerang) dan ferri amonium sitrat yang merupakan pengembang H 2 S.
Bakteri yang memiliki enzim tiosulfat reduktase memiliki kemampuan untuk bekerja dengan mereduksi natrium tiosulfat yang ada, membentuk sulfit dan hidrogen sulfida (H 2 S).
Yang terakhir adalah gas tidak berwarna, tetapi ketika bereaksi dengan garam besi membentuk sulfida logam besi, yang merupakan senyawa yang tidak larut (endapan hitam terlihat).
Namun, kemampuan untuk membentuk H 2 S dengan media ini tidak terlalu dapat diandalkan, karena beberapa bakteri negatif lisin dekarboksilase yang mampu menghasilkan H 2 S tidak akan membentuk endapan hitam, karena keasaman media mengganggu. Oleh karena itu, disarankan untuk memeriksa dengan media lain yang mengandung zat besi.
Interpretasi tes
dekarboksilasi lisin
Tabung harus dibaca setelah masa inkubasi 24 jam, jika tidak, ada risiko salah menafsirkan reaksi, melaporkan negatif palsu.
Harus diingat bahwa reaksi pertama yang akan terjadi adalah fermentasi glukosa, oleh karena itu semua tabung setelah 10 hingga 12 jam akan menguning.
Jika pada akhir waktu inkubasi (24 jam) diamati latar belakang kuning dengan permukaan ungu atau ungu, reaksinya negatif. Warna ungu pada permukaan sesuai dengan alkalisasi medium dengan menggunakan pepton.
Reaksi positif adalah reaksi di mana bagian bawah dan permukaan tabung benar-benar ungu, yaitu kembali ke warna aslinya.
Oleh karena itu, yang menentukan kepositifan tes adalah dasar atau latar belakang medium. Jika ragu tentang warnanya, dapat dibandingkan dengan tabung LIA yang tidak diinokulasi.
Deaminasi lisin
Sebuah tabung yang menunjukkan deaminasi lisin akan memiliki permukaan merah marun kemerahan dan latar belakang kuning (asam), atau seluruh tabung akan memiliki warna merah marun kemerahan.
Reaksi ini ditafsirkan sebagai negatif untuk dekarboksilasi lisin, tetapi positif untuk deaminasi lisin.
Reaksi ini didefinisikan dan ditafsirkan pada bezel.
Produksi hidrogen sulfida (H 2 S)
Reaksi positif diamati dengan munculnya endapan hitam di semua atau sebagian medium. Biasanya antara tepi bevel dan alas.
Jika endapan terjadi di seluruh tabung, tidak akan terungkap reaksi lain yang terjadi di tengah.
Catatan hasil
Saat menafsirkan tes, hasilnya dicatat sebagai berikut:
Bevel dibaca terlebih dahulu, lalu bagian bawah atau blok, lalu produksi H 2 S, dan terakhir produksi gas.
Contoh: K/A+ (-). Ini berarti:
- K: Bezel alkaline (warna ungu)
- A: Latar belakang asam (kuning), yaitu reaksi dekarboksilasi negatif dan deaminasi negatif.
- +: Produksi hidrogen sulfida
- (-): Tanpa bensin.
Persiapan
Timbang 35 g media lisin agar besi dehidrasi dan larutkan dalam satu liter air suling.
Panaskan sampai agar-agar benar-benar larut, untuk melakukannya, didihkan selama satu menit, sering diaduk. Distribusikan 4 ml media ke dalam tabung reaksi 13/100 dengan tutup kapas.
Sterilkan dalam autoklaf pada suhu 121°C selama 15 menit. Keluarkan dari autoklaf dan biarkan berdiri pada suatu sudut sehingga ada alas yang dalam dan bevel pendek.
Simpan di lemari es 2-8°C. Biarkan hangat sebelum menabur strain bakteri.
Warna media yang dikeringkan adalah krem dan media yang disiapkan berwarna ungu kemerahan.
PH akhir dari media yang disiapkan adalah 6,7 ± 0,2
Medium berubah menjadi kuning pada pH 5,2 atau kurang, dan menjadi ungu pada pH 6,5 ke atas.
Kegunaan
Tes ini, bersama dengan tes biokimia lainnya , digunakan untuk mengidentifikasi basil dari keluarga Enterobacteriaceae.
Media diunggulkan dengan loop atau jarum lurus, satu atau dua tusukan dibuat ke bagian bawah tabung, dan kemudian permukaan media dicetak secara zig-zag.
Inkubasi selama 24 jam pada suhu 35-37°C secara aerobiosis. Jika perlu, dibiarkan inkubasi selama 24 jam lagi.
Hal ini terutama berguna untuk membedakan spesies Citrobacter laktosa-negatif dari Salmonella sp.
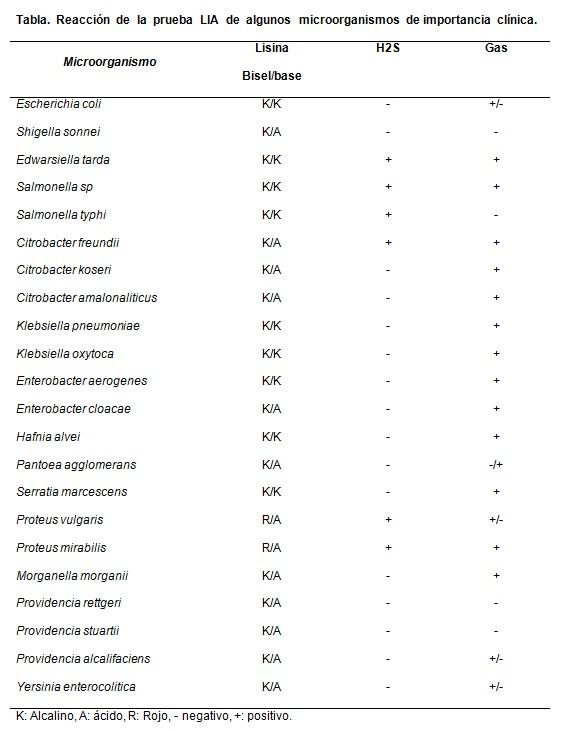
Sumber: Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. edisi ke-5. Editorial Panamericana SA Argentina.
Referensi
- Mac Faddin J. (2003). Tes biokimia untuk identifikasi bakteri yang penting secara klinis. edisi ke-3 Editorial Panamericana. Buenos Aires. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnosa Mikrobiologi Bailey & Scott. 12 edisi Editorial Panamericana SA Argentina.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnosa Mikrobiologi. edisi ke-5. Editorial Panamericana SA Argentina.
- Laboratorium Britannia. Agar besi lisin. 2015.Tersedia di: britanialab.com
- Laboratorium BD. BBL Lysine Iron Agar Miring. 2007. Tersedia di: bd.com
- Laboratorium Valtek. Medium LIA 2009.Tersedia di: andinamedica.com

