zinc finger (ZF) adalah struktur motif hadir dalam banyak protein eukariotik. Mereka termasuk dalam kelompok metaloprotein, karena mereka mampu mengikat ion logam seng, yang mereka butuhkan untuk operasi mereka. Lebih dari 1.500 domain ZF diperkirakan ada di sekitar 1.000 protein berbeda pada manusia.
Istilah jari seng atau “jari seng” pertama kali diciptakan pada tahun 1985 oleh Miller, McLachlan dan Klug, saat mempelajari secara rinci domain pengikat DNA kecil dari faktor transkripsi TFIIIA dari Xenopus laevis , dijelaskan oleh penulis lain beberapa tahun sebelumnya. .
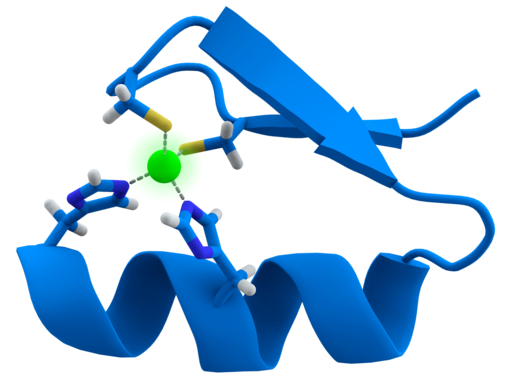
Representasi grafis dari motif jari seng dalam protein (Thomas Splettstoesser (www.scistyle.com) [GFDL (http://www.gnu.org/copyleft/fdl.html) atau CC BY-SA 4.0 (https: // creativecommons .org / licenses / by-sa / 4.0)], melalui Wikimedia Commons)
Protein dengan motif ZF termasuk yang paling melimpah dalam genom organisme eukariotik dan berpartisipasi dalam berbagai proses seluler penting, di antaranya adalah transkripsi gen, translasi protein, metabolisme, pelipatan dan perakitan protein dan lipid lain. , kematian sel terprogram. , diantara yang lain.
Indeks artikel
Struktur
Struktur motif ZF sangat terjaga. Biasanya daerah berulang ini memiliki 30 hingga 60 asam amino, struktur sekundernya ditemukan sebagai dua lembar beta antiparalel yang membentuk jepit rambut dan heliks alfa, dilambangkan sebagai .
Struktur sekunder tersebut distabilkan oleh interaksi hidrofobik dan oleh koordinasi atom seng yang diberikan oleh dua residu sistein dan dua histidin (Cys 2 His 2 ). Namun, ada ZF yang dapat mengoordinasikan lebih dari satu atom seng dan lainnya di mana urutan Cys dan residunya bervariasi.
ZF dapat diulang dalam batch, dikonfigurasi secara linier dalam protein yang sama. Mereka semua memiliki struktur yang serupa, tetapi secara kimiawi dapat dibedakan satu sama lain dengan variasi residu asam amino yang menjadi kunci pemenuhan fungsinya.
Fitur umum di antara ZF adalah kemampuannya untuk mengenali molekul DNA atau RNA dengan panjang yang berbeda, itulah sebabnya mereka pada awalnya dianggap hanya sebagai faktor transkripsi.
Secara umum, pengenalan adalah daerah 3bp dalam DNA dan dicapai ketika protein domain ZF menyajikan heliks alfa ke alur utama molekul DNA.
Klasifikasi
Ada berbagai motif ZF yang berbeda satu sama lain berdasarkan sifatnya dan konfigurasi spasial yang berbeda yang dicapai oleh ikatan koordinasi dengan atom seng. Salah satu klasifikasinya adalah sebagai berikut:
C 2 H 2
Ini adalah motif yang umum ditemukan di ZFs. Kebanyakan C 2 H 2 motif yang spesifik untuk interaksi dengan DNA dan RNA, namun, mereka telah diamati untuk berpartisipasi dalam interaksi protein-protein. Mereka memiliki antara 25 dan 30 residu asam amino dan ditemukan dalam keluarga protein pengatur terbesar dalam sel mamalia.
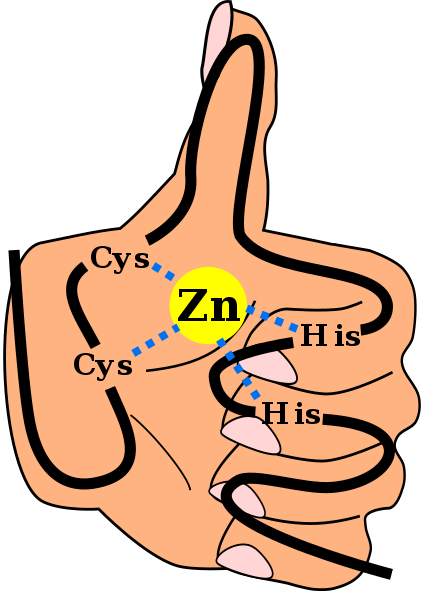
Struktur utama domain jari seng C2H2, termasuk ikatan yang mengoordinasikan ion seng dan dengan latar belakang “tangan dan jari” (AngelHerraez [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa /4.0 )], melalui Wikimedia Commons)
C 2 H
Mereka berinteraksi dengan RNA dan beberapa protein lainnya. Mereka terlihat terutama sebagai bagian dari beberapa protein kapsid retrovirus, membantu dalam pengemasan RNA virus setelah replikasi.
C 4 (busur atau pita)
Protein dengan motif ini adalah enzim yang bertanggung jawab untuk replikasi dan transkripsi DNA. Contoh yang baik dari ini adalah enzim kasar fag T4 dan T7.
C 4 (keluarga GATA)
Keluarga ZF ini terdiri dari faktor transkripsi yang mengatur ekspresi gen penting di banyak jaringan selama perkembangan sel. Faktor GATA-2 dan 3, misalnya, terlibat dalam hematopoiesis.
C 6
Domain ini unik untuk ragi, khususnya protein GAL4, yang mengaktifkan transkripsi gen yang terlibat dalam penggunaan galaktosa dan melibiosa.
Jari-jari seng (C 3 HC 4 -C 3 H 2 C 3 )
Struktur khusus ini memiliki 2 subtipe domain ZF (C 3 HC 4 dan C 3 H 2 C 3 ) dan terdapat dalam banyak protein hewani dan nabati.
Mereka ditemukan dalam protein seperti RAD5, yang terlibat dalam perbaikan DNA pada organisme eukariotik. Mereka juga ditemukan di RAG1, penting untuk konfigurasi ulang imunoglobulin.
H 2 C 2
Domain ZF ini sangat terkonservasi dalam integrase retrovirus dan retrotransposon; dengan mengikat protein target, itu menyebabkan perubahan konformasi di dalamnya.
Fitur
Protein dengan domain ZF melayani berbagai tujuan: mereka dapat ditemukan pada protein ribosom atau pada adaptor transkripsi. Mereka juga telah terdeteksi sebagai bagian integral dari struktur ragi RNA polimerase II.
Mereka tampaknya terlibat dalam homeostasis seng intraseluler dan dalam regulasi apoptosis atau kematian sel terprogram. Selain itu, ada beberapa protein ZF yang berfungsi sebagai pendamping untuk pelipatan atau pengangkutan protein lain.
Mengikat lipid dan peran mendasar dalam interaksi protein-protein juga merupakan fungsi yang menonjol dari domain ZF di beberapa protein.
Pentingnya bioteknologi
Selama bertahun-tahun, pemahaman struktural dan fungsional dari domain ZF telah memungkinkan kemajuan ilmiah besar yang melibatkan penggunaan karakteristik mereka untuk tujuan bioteknologi.
Karena beberapa protein ZF memiliki spesifisitas tinggi untuk domain DNA tertentu, banyak upaya saat ini diinvestasikan dalam desain ZF spesifik, yang dapat memberikan kemajuan berharga dalam terapi gen pada manusia.
Kegunaan bioteknologi yang menarik juga muncul dari desain protein dengan ZF rekayasa genetika. Tergantung pada tujuan yang diinginkan, beberapa di antaranya dapat dimodifikasi dengan penambahan peptida jari “poli seng”, yang mampu mengenali hampir semua urutan DNA dengan afinitas dan spesifisitas tinggi.
Pengeditan genom yang dimodifikasi nuklease adalah salah satu aplikasi yang paling menjanjikan saat ini. Jenis pengeditan ini menawarkan kemungkinan untuk melakukan studi tentang fungsi genetik secara langsung dalam sistem caral yang diminati.
Rekayasa genetika menggunakan nuklease ZF yang dimodifikasi telah menarik perhatian para ilmuwan di bidang perbaikan genetik kultivar tanaman yang penting secara agronomis. Nuklease ini telah digunakan untuk mengoreksi gen endogen yang menghasilkan bentuk tahan herbisida pada tanaman tembakau.
Nuklease dengan ZF juga telah digunakan untuk penambahan gen dalam sel mamalia. Protein yang dimaksud digunakan untuk menghasilkan satu set sel tikus isogenik dengan satu set alel yang ditentukan untuk gen endogen.
Proses semacam itu memiliki penerapan langsung dalam pelabelan dan pembuatan bentuk alelik baru untuk mempelajari hubungan struktur dan fungsi dalam kondisi ekspresi asli dan dalam lingkungan isogenik.
Referensi
- Berg, JM (1990). Domain jari seng: hipotesis dan pengetahuan saat ini. Tinjauan Tahunan Biofisika dan Kimia Biofisika , 19 (39), 405–421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J., & Barbas, C. (2001). Pengembangan domain jari seng untuk pengenalan keluarga sekuens DNA 5′-ANN-3 ‘dan penggunaannya dalam konstruksi faktor transkripsi buatan. JBC , (54).
- Gamsjaeger, R., Liew, CK, Loughlin, FE, Crossley, M., & Mackay, JP (2007). Jari lengket: jari seng sebagai motif pengenalan protein. Tren Ilmu Biokimia , 32 (2), 63-70.
- Klug, A. (2010). Penemuan Jari Seng dan Kegunaannya dalam Regulasi Gen dan Manipulasi Genom. Tinjauan Tahunan Biokimia , 79 (1), 213–231.
- Kluska, K., Adamczyk, J., & Krȩzel, A. (2017). Sifat pengikatan logam dari jari seng dengan situs pengikatan logam yang diubah secara alami. Metalomik , 10 (2), 248–263.
- Awam, JH, Lee, BM, & Wright, PE (2001). Protein jari seng: Wawasan baru tentang keragaman struktural dan fungsional. Opini Saat Ini dalam Biologi Struktural , 11 (1), 39–46.
- Miller, J., McLachlan, AD, & Klug, A. (1985). Domain pengikatan seng berulang dalam faktor transkripsi protein IIIA dari oosit Xenopus. Jurnal Unsur Jejak dalam Pengobatan Eksperimental , 4 (6), 1609–1614.
- Urnov, FD, Rebar, EJ, Holmes, MC, Zhang, HS, & Gregory, PD (2010). Pengeditan genom dengan nuklease jari seng yang direkayasa. Ulasan Alam Genetika , 11 (9), 636–646.

