histokimia adalah alat yang berguna dalam studi morfologi dari berbagai jaringan biologis (tanaman dan hewan) karena prinsip reaksinya komponen jaringan seperti karbohidrat, lipid dan protein, antara lain, pewarna kimia.
Alat yang berharga ini memungkinkan tidak hanya untuk mengidentifikasi komposisi dan struktur jaringan dan sel, tetapi juga berbagai reaksi yang terjadi di dalamnya. Demikian juga, kemungkinan kerusakan jaringan, yang disebabkan oleh adanya mikroorganisme atau patologi lainnya, dapat dibuktikan.
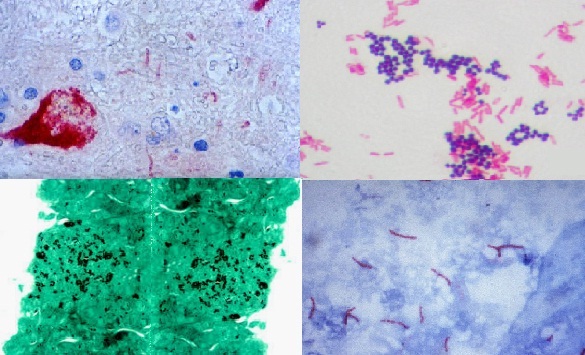
Noda histokimia. Virus Nil, bakteri Gram positif dan Gram negatif (Gram), Histoplasma capsulatum (Grocott), Mycobacterium tuberculosis (Ziehl Neelsen). Sumber: Pixinio.com/Wikipedia.org/Nephron [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)íritu/CDC/Dr. George P. Kubica [Domain publik]
Histokimia, dari abad yang lalu telah memberikan kontribusi penting, seperti demonstrasi keberadaan sawar darah-otak oleh Paul Ehrlich. Hal ini dimungkinkan karena otak hewan percobaan yang digunakan oleh Ehrlich tidak diwarnai dengan anilin, yang merupakan pewarna dasar.
Hal ini menyebabkan penggunaan berbagai pewarna seperti metilen biru dan indofenol, untuk mewarnai berbagai jenis sel. Temuan ini memunculkan klasifikasi sel menjadi asidofilik, basofilik dan neutrofilik, menurut pewarnaan spesifiknya.
Studi terbaru telah menerapkan teknik ini untuk menunjukkan adanya berbagai senyawa, termasuk fenol, serta karbohidrat dan lipid non-struktural, dalam jaringan spesies Litsea glaucescens , lebih dikenal sebagai laurel. Menemukan ini, baik di daun maupun di kayu.
Demikian pula Colares et al, 2016, mengidentifikasi tanaman obat bunga Tareaya kerumitanriana , menggunakan teknik histokimia. Dalam spesies ini keberadaan pati, myrosine, serta senyawa fenolik dan lipofilik dibuktikan.
Indeks artikel
Dasar
Histokimia didasarkan pada pewarnaan struktur seluler atau molekul yang ada dalam jaringan, berkat afinitasnya dengan pewarna tertentu. Reaksi pewarnaan struktur atau molekul ini dalam format aslinya, kemudian divisualisasikan dalam mikroskop optik atau mikroskop elektron.
Spesifisitas pewarnaan disebabkan oleh adanya gugus akseptor ion yang ada dalam sel atau molekul jaringan.
Akhirnya, tujuan reaksi histokimia adalah untuk dapat menunjukkannya dengan pewarnaan. Dari struktur biologis terbesar hingga terkecil dari jaringan dan sel. Hal ini dapat dicapai berkat fakta bahwa pewarna bereaksi secara kimia dengan molekul jaringan, sel atau organel.
Penuntutan
Reaksi histokimia dapat melibatkan langkah-langkah sebelum melakukan teknik, seperti fiksasi, penanaman dan pemotongan jaringan. Oleh karena itu, harus diperhitungkan bahwa dalam langkah-langkah ini struktur yang akan diidentifikasi dapat rusak, menghasilkan hasil negatif palsu, bahkan jika ada.
Meskipun demikian, fiksasi jaringan sebelumnya dilakukan dengan benar adalah penting, karena mencegah autolisis atau penghancuran sel. Untuk ini, reaksi kimia digunakan dengan pelarut organik seperti: formaldehida atau glutaraldehid, antara lain.
Penyertaan kain dilakukan untuk mempertahankan kekencangannya saat dipotong dan dengan demikian mencegahnya berubah bentuk. Akhirnya, potongan dibuat dengan mikrotom untuk studi sampel dengan mikroskop optik.
Selain itu, sebelum melanjutkan untuk melakukan pewarnaan histokimia, dianjurkan untuk memasukkan kontrol positif eksternal atau internal di setiap batch tes. Serta penggunaan pewarna khusus untuk struktur yang akan dipelajari.
Noda histokimia
Dari munculnya teknik histokimia hingga saat ini, berbagai pewarnaan telah digunakan, di antaranya yang paling sering digunakan seperti: Periodic acid Schiff (PAS), Grocott, Ziehl-Neelsen dan Gram.
Demikian juga, pewarna lain telah digunakan lebih jarang seperti tinta India, orcein atau pewarna trikrom Masson, antara lain.
Schiff Asam Berkala (PAS)
Dengan pewarnaan ini, molekul dengan kandungan karbohidrat tinggi dapat diamati, seperti: glikogen dan musin. Namun, juga berguna untuk identifikasi mikroorganisme seperti jamur dan parasit. Selain struktur tertentu (membran dasar) di kulit dan di jaringan lain.
Dasar pewarnaan ini adalah bahwa pewarna mengoksidasi ikatan karbon yang ada di antara dua gugus hidroksil di dekatnya. Ini menghasilkan pelepasan gugus aldehida, dan ini dideteksi oleh pereaksi Schiff, mengeluarkan warna ungu.
Reagen Schiff terdiri dari fuchsin dasar, natrium metabisulfit dan asam klorida, komponen ini bertanggung jawab untuk pewarnaan ungu, ketika kelompok aldehida hadir. Jika tidak, asam tidak berwarna dihasilkan.
Intensitas pewarnaan akan tergantung pada jumlah gugus hidroksil yang ada dalam monosakarida. Misalnya, pada jamur, membran basal, musin, dan glikogen, warnanya dapat berkisar dari merah hingga ungu, sedangkan nukleus berwarna biru.
Grokot
Ini adalah salah satu noda dengan sensitivitas tertinggi dalam mengidentifikasi jamur di jaringan parafin-embedded. Hal ini memungkinkan identifikasi berbagai struktur jamur: antara lain hifa , spora, endospora. Oleh karena itu, ini dianggap sebagai pewarnaan rutin untuk diagnosis mikosis.
Hal ini terutama digunakan dalam diagnosis mikosis paru seperti pneumocystosis dan aspergillosis yang disebabkan oleh beberapa jamur dari genus Pneumocystis dan Aspergillus, masing-masing.
Larutan ini mengandung perak nitrat dan asam kromat, yang terakhir menjadi fiksatif dan pewarna. Dasarnya adalah bahwa asam ini menghasilkan oksidasi gugus hidroksil menjadi aldehida, oleh mucopolyacharides yang ada dalam struktur jamur, misalnya di dinding sel jamur.
Akhirnya, perak yang ada dalam larutan dioksidasi oleh aldehida, menyebabkan warna hitam, yang disebut reaksi argentafin. Pewarna kontras seperti hijau muda juga dapat digunakan dan dengan demikian struktur jamur akan diamati dalam warna hitam dengan latar belakang hijau muda.
Ziehl-Neelsen
Pewarnaan ini didasarkan pada adanya resistensi asam-alkohol, sebagian atau seluruhnya, pada beberapa mikroorganisme seperti genus Nocardia , Legionella dan Mycobacterium.
Penggunaan pewarna ini dianjurkan, karena dinding sel mikroorganisme yang disebutkan sebelumnya mengandung lipid kompleks yang menghambat penetrasi pewarna. Terutama pada sampel dari saluran pernapasan.
Di dalamnya digunakan pewarna kuat seperti carbol fuchsin (pewarna dasar) dan dipanaskan agar mikroorganisme dapat menahan pewarna dan tidak berubah warna dengan asam dan alkohol. Akhirnya, larutan biru metilen diterapkan untuk mewarnai struktur yang telah berubah warna.
Kehadiran resistensi asam-alkohol diamati pada struktur yang diwarnai merah, sedangkan struktur yang tidak tahan fading diwarnai biru.
Gram dan tinta cina
Gram adalah pewarna yang sangat berguna dalam diagnosis infeksi bakteri dan jamur, antara lain. Pewarnaan ini memungkinkan untuk membedakan antara mikroorganisme Gram-positif dan Gram-negatif, dengan jelas menunjukkan perbedaan yang ada pada komposisi dinding sel.
Sedangkan tinta India adalah pewarna yang digunakan untuk mengkontraskan struktur yang mengandung polisakarida (kapsul). Ini karena sebuah cincin terbentuk di lingkungan, yang mungkin terjadi di Cryptococcus neoformans .
orcein
Dengan pewarnaan ini, serat elastis dan kromosom dari berbagai sel diwarnai, memungkinkan evaluasi proses pematangan yang terakhir. Untuk alasan ini, telah sangat berguna dalam studi sitogenetik.
Ini didasarkan pada penyerapan zat warna oleh muatan negatif molekul seperti DNA , yang ada dalam inti berbagai sel. Jadi ini diwarnai biru ke ungu tua.
Trikrom Masson
Pewarnaan ini digunakan untuk mengidentifikasi beberapa mikroorganisme atau bahan yang mengandung pigmen melanik. Ini adalah kasus mikosis, yang disebabkan oleh jamur dematiaceous, pheohifomycosis dan eumycetoma berbutir hitam.
Pikiran terakhir
Dalam beberapa tahun terakhir ada banyak kemajuan dalam penciptaan teknik diagnostik baru, di mana histokimia terlibat tetapi terkait dengan fondasi atau prinsip lain. Teknik-teknik ini memiliki tujuan yang berbeda, seperti imunohistokimia atau enzymohistochemistry.
Referensi
- Acuña U, Elguero J. Histoquímica. A. Kimia. 2012; 108 (2): 114-118. Tersedia di: are.iqm.csic.es
- Mestanza R. Frekuensi pewarnaan histokimia PAS, Grocott dan Ziehl-Neelsen yang digunakan untuk identifikasi mikroorganisme, dilakukan di Pelayanan Patologi Anatomi Rumah Sakit Khusus Eugenio Espejo tahun 2015. [Tesis Sarjana]. Universitas Pusat Ekuador, Quito; 2016.Tersedia di: dspace.uce.edu
- Tapia-Torres N, Peace-Pérez-Olvera C, Roman-prajurit, Quintanar-Isaías A, Garcia-Marquez E, F. Sosa Cruz-histokimia, kandungan fenolik total dan aktivitas antioksidan daun dan kayu Litsea glaucescens Kunth (Lauraceae). Kayu dan Hutan. 2014; 20 (3): 125-137. Tersedia di: redalyc.org
- Colares, MN, Martínez-Alonso, S, Arambarri, AM. Anatomi dan histokimia Tarenaya kerumitanriana (Cleomaceae), spesies bunga obat. Buletin Tanaman Obat dan Aromatik Amerika Latin dan Karibia 2016; 15 (3): 182-191. Tersedia di: redalyc.org
- Bonifaz A. Mikologi medis dasar. edisi ke-4. Meksiko: editor McGraw-Hill Interamericana, SA de CV 2012.
- Silva Diego Filipe Bezerra, Santos Hellen Bandeira de Pontes, León Jorge Esquiche, Gomes Daliana Queiroga de Castro, Alves Pollianna Muniz, Nonaka Cassiano Francisco Weege. Analisis patologis dan imunohistokimia klinis dari karsinoma sel skuamosa sel gelendong lidah: kasus yang jarang terjadi. Einstein (So Paulo) 2019; 17 (1): eRC4610. Tersedia dari: scielo.br

