asparagin (Asn atau N) adalah asam amino yang penting untuk sel sinyal dan mengikat antara protein dan karbohidrat. Ini adalah salah satu dari 22 asam amino dasar dan diklasifikasikan sebagai non-esensial, karena disintesis oleh tubuh mamalia.
Asam amino ini diklasifikasikan dalam kelompok asam amino polar yang tidak bermuatan dan merupakan asam amino pertama yang ditemukan, fakta yang terjadi pada tahun 1806, di mana ia diisolasi dari jus asparagus (sejenis tanaman herba) oleh ahli kimia Prancis Vauquelin dan Robiket.
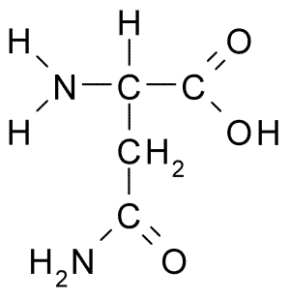
Struktur kimia asam amino Asparagine (Sumber: Borb, via Wikimedia Commons)
Meskipun penemuan awal, peran biologis dan gizi asparagin tidak diakui sampai lebih dari 100 tahun kemudian ketika, pada tahun 1932, kehadirannya dalam struktur protein hadir dalam biji rami dikonfirmasi.
Asparagin dan glutamin berfungsi sebagai substrat untuk gugus amida dari dua asam amino lain yang sangat umum dalam protein: masing-masing aspartat (asam aspartat) dan glutamat (asam glutamat). Asparagin dan glutamin mudah dihidrolisis menjadi asam amino ini melalui aksi enzimatik atau oleh senyawa asam dan basa.
Banyak enzim protease serin yang menghidrolisis ikatan peptida memiliki asparagin pada rantai samping situs aktifnya. Residu ini memiliki muatan negatif parsial dan bertugas untuk bergabung secara komplementer dengan muatan positif dari peptida target, membawa mereka lebih dekat ke tempat pembelahan.
Enzim yang bertanggung jawab untuk sintesis oksaloasetat dari asparagin digunakan dalam perawatan kemoterapi dan dikenal sebagai L-asparaginase, yang bertanggung jawab untuk mengkatalisis fragmentasi hidrolitik gugus amida asparagin menjadi aspartat dan amonium.
Asparaginase diekspresikan secara berlebihan dan dimurnikan dari Escherichia coli , untuk disuntikkan pada pasien anak-anak dengan leukemia limfoblastik akut, karena limfosit normal dan ganas bergantung pada penangkapan asparagin dalam darah untuk pertumbuhan dan multiplikasinya.
Indeks artikel
Karakteristik dan struktur
Semua struktur kimia asam amino memiliki gugus karboksil (-COOH), gugus amino (-NH3 +), hidrogen (-H) dan gugus R atau substituen yang terikat pada atom karbon pusat yang sama, yang dikenal sebagai karbon. .
Asam amino berbeda satu sama lain dengan identitas rantai sampingnya, yang dikenal sebagai gugus R dan dapat bervariasi dalam ukuran, struktur, gugus fungsi, dan bahkan muatan listrik.
Atom karbon dari gugus R diidentifikasi dengan huruf alfabet Yunani. Jadi, dalam kasus asparagin, karbon rantai R diidentifikasi sebagai karbon dan .
Menurut jenis penamaan lainnya, atom karbon dalam gugus karboksil (-COOH) terdaftar sebagai C-1, jadi, melanjutkan penomoran, -karbon akan menjadi C-2 dan seterusnya.
Molekul asparagin memiliki empat atom karbon, termasuk -karbon, karbon dari gugus karboksil, dan dua atom karbon yang merupakan bagian dari gugus R, yang dikenal sebagai karboksamida (-CH2-CO-NH2).
Gugus karboksamida ini hanya ditemukan dalam dua asam amino: dalam asparagin dan dalam glutamin. Ia memiliki karakteristik dapat membentuk ikatan hidrogen dengan sangat mudah melalui gugus amino (-NH2) dan gugus karbonil (-CO).
Klasifikasi
Asparagin termasuk dalam kelompok asam amino polar yang tidak bermuatan, yang merupakan asam amino yang sangat larut dalam air dan sangat hidrofilik (karena kemampuannya untuk membentuk banyak ikatan hidrogen).
Serin, treonin, sistein, dan glutamin juga ditemukan dalam kelompok asam amino polar yang tidak bermuatan. Semua ini adalah senyawa ” zwitterionic “, karena mereka memiliki gugus polar dalam rantai R mereka yang berkontribusi pada netralisasi muatan.
Semua asam amino polar yang tidak bermuatan tidak dapat terionisasi pada pH mendekati 7 (netral), yaitu, mereka tidak memiliki muatan positif atau negatif. Namun, dalam media asam dan basa, substituen terionisasi dan memperoleh muatan.
Stereokimia
Karbon pusat atau karbon dari asam amino adalah karbon kiral, oleh karena itu, ia memiliki empat substituen yang berbeda, yang berarti bahwa setidaknya ada dua stereoisomer yang dapat dibedakan untuk setiap asam amino.
Stereoisomer adalah bayangan cermin dari molekul yang memiliki rumus molekul yang sama, tetapi tidak dapat ditumpangkan, seperti tangan (kiri dan kanan). Mereka dilambangkan dengan huruf D atau L, karena secara eksperimental larutan asam amino ini memutar bidang cahaya terpolarisasi ke arah yang berlawanan.
Asimetri umum asam amino membuat stereokimia senyawa ini sangat penting, karena masing-masing memiliki sifat yang berbeda, disintesis dan berpartisipasi dalam jalur metabolisme yang berbeda.
Asparagin dapat ditemukan dalam bentuk D-asparagin atau L-asparagin, yang terakhir adalah yang paling umum di alam. Ini disintesis oleh L-asparagin sintetase dan dimetabolisme oleh L-asparaginase, kedua enzim tersebut sangat melimpah di hati vertebrata .
Fitur
Kemudahan ikatan hidrogen asparagin menjadikannya asam amino penting untuk stabilitas struktural protein, karena dapat membentuk ikatan hidrogen internal dengan rantai samping asam amino lain yang menyusunnya.
Asparagin biasanya ditemukan pada permukaan protein media berair yang khas, menstabilkan strukturnya.
Banyak glikoprotein dapat melekat pada karbohidrat atau karbohidrat melalui residu asparagin, treonin, atau serin. Dalam kasus asparagin, asetil galaktosamin umumnya pertama kali dilekatkan pada gugus amino melalui N-glikosilasi.
Penting untuk dicatat bahwa di semua glikoprotein N-terglikosilasi, karbohidrat mengikatnya melalui residu asparagin yang ditemukan di wilayah tertentu yang dilambangkan sebagai Asn-X-Ser / Thr, di mana X adalah asam amino apa pun.
Glikoprotein ini dirakit di retikulum endoplasma, di mana mereka diglikosilasi saat diterjemahkan.
Biosintesis
Semua organisme eukariotik mengasimilasi amonia dan mengubahnya menjadi glutamat, glutamin, karbamil fosfat, dan asparagin. Asparagin dapat disintesis dari intermediet glikolitik, dalam siklus asam sitrat (dari oksaloasetat) atau dari prekursor yang dikonsumsi dalam makanan.
Enzim asparagin sintetase adalah amidotransferase yang bergantung pada glutamin dan ATP yang memecah ATP menjadi AMP dan pirofosfat anorganik (PPi) dan menggunakan amonia atau glutamin untuk mengkatalisis reaksi amidasi dan mengubah aspartat menjadi asparagin.
Baik bakteri maupun hewan memiliki asparagin sintetase, namun pada bakteri enzim menggunakan ion amonium sebagai donor nitrogen, sedangkan pada mamalia asparagin sintetase menggunakan glutamin sebagai donor utama kelompok nitrogen.
Pemecahan enzimatik molekul ATP menjadi AMP dan pirofosfat anorganik (PPi), bersama dengan glutamin sebagai donor gugus amida, adalah perbedaan utama sehubungan dengan biosintesis L-glutamin antara organisme yang berbeda.
Degradasi
Sebagian besar studi tentang metabolisme asparagin telah dilakukan pada tanaman , karena studi mamalia pada awalnya terhambat oleh kurangnya metodologi yang cukup sensitif untuk pengujian asam amino pada tingkat sistem yang lebih kompleks.
L-asparagin secara konstan dihidrolisis pada mamalia oleh L-asparaginase untuk menghasilkan asam aspartat dan amonium. Ini digunakan untuk sintesis glikoprotein dan merupakan salah satu prekursor oksaloasetat utama untuk siklus asam sitrat.
Enzim asparaginase mengkatalisis hidrolisis asparagin menjadi aspartat, selanjutnya aspartat ditransaminasi dengan -ketoglutarat untuk menghasilkan glutamat dan oksaloasetat.
Asparagin sintetase, juga dikenal sebagai ligase amonia aspartat, banyak ditemukan di sel otak mamalia dewasa.
Ketika tingkat rendah enzim ini dirasakan dalam tubuh, apa yang dikenal sebagai “aminoasidopati” terbentuk, sebagai substrat prekursor menumpuk di sitoplasma sel-sel otak.
Makanan kaya asparagin
Orang dengan leukemia limfoblastik akut biasanya memiliki defisiensi enzim asparagin sintetase dan bergantung pada asparagin yang berperedaran, sehingga dianjurkan untuk diet kaya asparagin atau suplai eksogen.
Di antara banyak makanan dengan kandungan asparagin tinggi adalah kerang, unggas dan telurnya, sapi potong, produk susu dan turunannya, dan sayuran seperti asparagus, kentang, umbi-umbian, dll.
Ada konsentrat L-asparagine yang diformulasikan untuk atlet yang sangat kompetitif, karena konsumsinya membantu meregenerasi protein yang membentuk jaringan.
Selain itu, orang yang mengalami defisit sintesis asam amino juga mengonsumsi tablet ini untuk menghindari gangguan pada sistem saraf pusat mereka .
Asparagin lebih mudah dimetabolisme melalui bentuk L-asparaginnya, karena banyak enzim yang terlibat dalam metabolismenya tidak mengenali bentuk D-asparagin dan, oleh karena itu, tidak semua asparagin yang dicerna dalam makanan tersedia untuk proses tubuh yang berbeda.
Asupan asparagin yang melimpah dapat bermanfaat, namun dianjurkan untuk tidak mengonsumsinya secara berlebihan dalam bentuk tablet, karena telah ditentukan bahwa konsentrasi L-asparagin yang melimpah dari obat-obatan meningkatkan perkembangan sel tumor.
Referensi
- Cooney, DA, Capizzi, RL, & Handschumacher, RE (1970). Evaluasi metabolisme L-asparagin pada hewan dan manusia. Penelitian kanker , 30 (4), 929-935
- Dunlop, PC, Roon, RJ, & Genap, HL (1976). Pemanfaatan D-asparagin oleh Saccharomyces cerevisiae. Jurnal Bakteriologi , 125 (3), 999-1004.
- Kambhampati, S., Ajewole, E., & Marsolais, F. (2017). Kemajuan dalam metabolisme asparagin. Sedang Berproses di Botani Vol.79 (hlm. 49-74). Pegas, Cham.
- Kornfeld, R., & Kornfeld, S. (1985). Perakitan oligosakarida terkait asparagin. Tinjauan tahunan Biokimia , 54 (1), 631-664
- Mathews, CK, & Ahern, KG (2002). Biokimia. Pendidikan Pearson.
- Nelson, DL, Lehninger, AL, & Cox, MM (2008). Prinsip biokimia Lehninger. Macmillan.
- Yamada, K., Hashizume, D., Shimizu, T., & Yokoyama, S. (2007). l-asparagin. Acta Crystallographica Bagian E: Laporan Struktur Online, 63 (9), 3802-3803.

