Beta amiloid (AB) atau beta amiloid peptida (ABP) adalah nama yang diberikan untuk peptida dari 39-43 asam amino dan antara 4-6 kDa dalam berat molekul yang merupakan produk metabolisme protein prekursor amiloid (APP) ketika diproses melalui jalur amiloidogenik.
Istilah amiloid (seperti pati) mengacu pada fakta bahwa endapan protein ini menyerupai butiran pati yang pertama kali terlihat pada jaringan tanaman cadangan. Saat ini, istilah tersebut dikaitkan dengan peptida dan protein yang mengadopsi morfologi serat tertentu dalam sistem saraf .
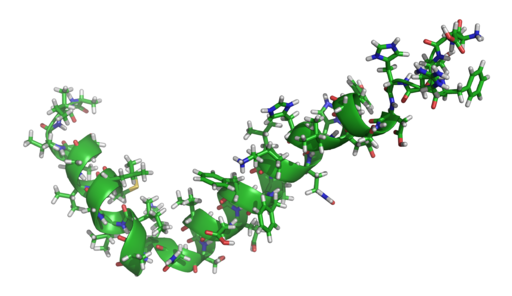
Struktur peptida amiloid beta (Pekerjaan sendiri [Domain publik], melalui Wikimedia Commons)
ABP sesuai dengan segmen terminal-C transmembran dari protein APP. Gen yang mengkode APP terletak pada kromosom 21 dan mengalami penyambungan alternatif yang menghasilkan berbagai isoform protein.
Varian atau isoform yang berbeda diekspresikan di seluruh tubuh. Isoform otak yang dominan adalah yang tidak memiliki domain penghambatan protease serin.
Sejumlah kecil ABP memainkan peran penting dalam perkembangan saraf dan dalam regulasi transmisi kolinergik, yang penting dalam sistem saraf pusat . Kelimpahannya tergantung pada keseimbangan antara sintesis dan degradasinya, yang dikendalikan secara enzimatis.
Bagian penting dari penanda patofisiologi penyakit Alzheimer kongenital dan lanjut terkait dengan ABP, terutama dengan pembentukan plak senilis karena deposisi berlebihan dalam sel saraf, pembentukan kusut atau kusut fibrilar dan degenerasi sinaptik.
Indeks artikel
Sumber
ABP berasal dari pembelahan enzimatik protein prekursor APP, yang diekspresikan pada tingkat tinggi di otak dan dimetabolisme dengan cepat dalam cara yang kompleks.
Protein ini termasuk dalam famili glikoprotein transmembran tipe 1 dan fungsinya tampaknya bertindak sebagai reseptor vesikular untuk protein motorik Kinesin I. Protein ini juga terlibat dalam regulasi sinaps , transpor neuron, dan ekspor seluler ion besi.
Protein APP disintesis dalam retikulum endoplasma , diglikosilasi dan dikirim ke kompleks Golgi untuk pengemasan selanjutnya dalam vesikel transpor yang mengantarkannya ke membran plasma .
Ia memiliki domain transmembran tunggal, ujung terminal-N yang panjang, dan bagian terminal-C intraseluler kecil. Ini diproses secara enzimatik dalam dua cara berbeda: rute non-amiloidogenik dan rute amiloidogenik.
Pada jalur non-amiloidogenik, protein APP dipecah oleh membran – dan -sekretase, yang memotong segmen yang dapat larut dan fragmen transmembran, melepaskan bagian terminal-C yang mungkin terdegradasi dalam lisosom . Dikatakan non-amiloidogenik karena tidak ada bagian yang menghasilkan peptida ABP penuh.
Jalur amiloidogenik, di sisi lain, juga melibatkan aksi berurutan dari BACE1 -secretase dan kompleks -secretase, yang juga merupakan protein membran integral.
Pembelahan yang diinduksi -secretase melepaskan fragmen protein yang dikenal sebagai sAPPα dari permukaan sel, meninggalkan segmen kurang dari 100 asam amino dari terminal-C yang dimasukkan ke dalam membran.
Bagian membran ini dipotong oleh -secretase, yang produknya dapat diproses berkali-kali oleh kompleks -secretase, menghasilkan fragmen dengan panjang yang berbeda (dari 43 hingga 51 asam amino).
Peptida yang berbeda memenuhi fungsi yang berbeda: beberapa dapat ditranslokasikan ke nukleus, menjalankan peran regulasi genetik; lain tampaknya terlibat dalam pengangkutan kolesterol melalui membran, sementara yang lain berpartisipasi dalam pembentukan plak atau gumpalan, beracun untuk aktivitas saraf.
Struktur
Urutan asam amino utama dari peptida AB ditemukan pada tahun 1984 dengan mempelajari komponen plak amiloid dari pasien dengan penyakit Alzheimer.
Karena kompleks -secretase dapat membuat potongan sembarangan di segmen yang dilepaskan oleh -secretase, ada berbagai molekul ABP. Karena strukturnya tidak dapat dikristalkan dengan metode umum, mereka dianggap termasuk dalam kelas protein yang tidak terstruktur secara intrinsik.
Model yang diturunkan dari studi menggunakan resonansi magnetik nuklir (NMR) telah menetapkan bahwa banyak peptida AB memiliki struktur sekunder dalam bentuk heliks yang dapat berevolusi menjadi bentuk yang lebih kompak tergantung pada lingkungan di mana ia ditemukan.
Karena sekitar 25% dari permukaan molekul ini memiliki karakter hidrofobik yang kuat, adalah umum untuk mengamati kumparan semi-stabil yang mengarah pada konformasi lipatan , yang memainkan peran mendasar dalam keadaan agregasi peptida tersebut.
Toksisitas
Efek neurotoksik dari protein ini berhubungan dengan bentuk larut dan agregat tidak larut. Oligomerisasi terjadi secara intraseluler dan konglomerat yang lebih besar merupakan unsur terpenting dalam pembentukan plak senilis dan neurofibrillary tangles, penanda penting neuropatologi seperti penyakit Alzheimer.
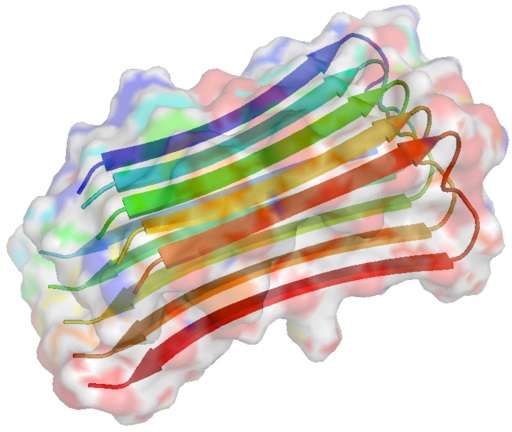
Struktur serat ABP (Boku wa Kage [GFDL (http://www.gnu.org/copyleft/fdl.html) atau CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/ 4.0) ], melalui Wikimedia Commons)
Mutasi pada gen APP, serta pada gen yang mengkode sekretase yang terlibat dalam pemrosesannya, dapat menyebabkan deposisi besar peptida AB yang menimbulkan amiloidopati yang berbeda, termasuk amiloidopati Belanda.
Partisipasi ABP dalam pelepasan mediator respon inflamasi dan radikal bebas yang memiliki efek merusak pada sistem saraf pusat dengan memicu kaskade kematian sel telah disorot . Ini juga menyebabkan pertumbuhan berlebih neuron, menginduksi stres oksidatif, dan mendorong aktivasi sel glial .
Beberapa bentuk peptida AB menyebabkan pembentukan asam nitrat dan masuknya ion kalsium yang berlebihan ke dalam sel dengan meningkatkan ekspresi reseptor ryanodine di neuron, yang akhirnya menyebabkan kematian sel.
Akumulasinya di pembuluh darah otak dikenal sebagai angiopati serebro-amiloid dan ditandai dengan menyebabkan vasokonstriksi dan hilangnya tonus pembuluh darah.
Jadi, dalam konsentrasi tinggi, selain neurotoksisitasnya, akumulasi ABP melemahkan aliran darah ke struktur otak dan mempercepat kerusakan saraf.
Karena protein prekursor ABP dikodekan pada kromosom 21, pasien dengan sindrom Down (yang memiliki trisomi pada kromosom ini), jika mereka mencapai usia tua, lebih rentan terhadap penyakit yang berkaitan dengan peptida AB.
Referensi
- Breydo, L., Kurouski, D., Rasool, S., Milton, S., Wu, JW, Uversky, VN, Glabe, CG (2016). Perbedaan struktural antara oligomer beta amiloid. Komunikasi Riset Biokimia dan Biofisika , 477 (4), 700–705.
- Cheignon, C., Tomas, M., Bonnefont-Rousselot, D., Faller, P., Hureau, C., & Collin, F. (2018). Stres oksidatif dan peptida beta amiloid pada penyakit Alzheimer. Biologi Redoks , 14 , 450–464.
- Chen, GF, Xu, TH, Yan, Y., Zhou, YR, Jiang, Y., Melcher, K., & Xu, HE (2017). Amyloid beta: Struktur, biologi, dan pengembangan terapi berbasis struktur. Acta Pharmacologica Sinica , 38 (9), 1205–1235.
- Coria, F., Moreno, A., Rubio, I., García, M., Morato, E., & Walikota, F. (1993). Patologi seluler yang terkait dengan deposit B-amiloid pada individu lanjut usia yang tidak mengalami demensia. Neuropatologi Terapan Neurobiologi , 19 , 261-268.
- Du Yan, S., Chen, X., Fu, J., Chen, M., Zhu, H., Roher, A., … Schmidt, A. (1996). RAGE dan neurotoksisitas peptida amiloid-beta pada penyakit Alzheimer. Alam , 382 , 685-691.
- Hamley, IW (2012). Amyloid Beta Peptide: Peran Perspektif Seorang Ahli Kimia di Alzheimer dan Fibrillization. Ulasan Kimia , 112 (10), 5147-5192.
- Hardy, J., & Higgins, G. (1992). Penyakit Alzheimer: Hipotesis Kaskade Amiloid. Sains , 256 (5054), 184-185.
- Menendez, S., Padron, N., & Llibre, J. (2002). Beta Amyloid Peptide, Protein TAU dan Penyakit Alzheimer. Rev Cubana Invest Biomed , 21 (4), 253–261.
- Sadigh-Eteghad, S., Sabermarouf, B., Majdi, A., Talebi, M., Farhoudi, M., & Mahmoudi, J. (2014). Amyloid-beta: Faktor penting dalam penyakit Alzheimer. Prinsip dan Praktik Medis , 24 (1), 1–10.
- Selkoe, DJ (2001). Membersihkan Jaring Laba-laba Amiloid Otak. Neuron , 32 , 177–180.
- Yao, ZX, & Papadopoulos, V. (2002). Fungsi beta-amiloid dalam transportasi kolesterol: menyebabkan neurotoksisitas. Jurnal FASEB , 16 (12), 1677–1679.

