allosterism atau alosterik regulasi didefinisikan sebagai proses penghambatan atau aktivasi enzim dimediasi oleh molekul yang berbeda peraturan dari substrat dan yang bertindak di situs tertentu dari struktur, berbeda dengan situs aktif daripadanya.
Istilah “alosterik” atau “allosterisme” berasal dari akar kata Yunani ” allos” , yang berarti “lain” dan “stereós” , yang berarti “bentuk” atau “tempat”; sehingga secara harfiah diterjemahkan sebagai “ruang lain”, “tempat lain” atau “struktur lain”.
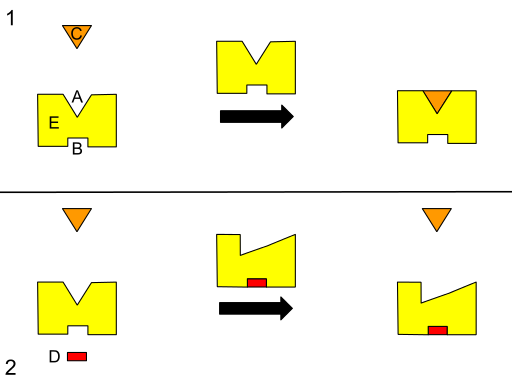
Diagram grafis dari regulasi alosterik. (A) Situs aktif. (B) Situs alosterik. (C) Substrat. (D) Penghambat. (E) Enzim. (Sumber: Isaac Webb [CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0)] Melalui Wikimedia Commons)
Beberapa penulis menggambarkan allosterisme sebagai proses di mana situs-situs terpencil dalam suatu sistem (struktur enzim, misalnya) digabungkan secara energetik untuk menghasilkan respons fungsional, oleh karena itu dapat diasumsikan bahwa perubahan di suatu wilayah dapat memengaruhi yang lain. di dalamnya.
Jenis regulasi ini adalah tipikal enzim yang berpartisipasi dalam beberapa proses biologis yang diketahui, seperti transduksi sinyal, metabolisme (anabolisme dan katabolisme), regulasi ekspresi gen, antara lain.
Ide pertama tentang allosterisme dan partisipasinya dalam kontrol metabolisme sel dipostulasikan pada tahun 1960 oleh F. Monod, F. Jacob dan J. Changeux, sementara mereka mempelajari jalur biosintetik asam amino yang berbeda, yang dihambat setelah akumulasi produk akhir.
Meskipun publikasi pertama dalam hal ini berkaitan dengan regulasi genetik, tak lama kemudian Monod, Wyman dan Changeux memperluas konsep allosterisme menjadi protein dengan aktivitas enzimatik dan mengusulkan caral berdasarkan protein multimerik, yang terutama didasarkan pada interaksi antar subunit. dari ini melekat pada efektor.
Banyak dari konsep kemudian memiliki dasar dalam teori “kecocokan yang diinduksi” yang diperkenalkan oleh Koshland beberapa tahun sebelumnya.
Indeks artikel
Fitur umum
Secara umum, semua enzim memiliki dua situs yang berbeda untuk pengikatan ligan: satu dikenal sebagai situs aktif, di mana molekul yang berfungsi sebagai substrat (bertanggung jawab atas aktivitas biologis enzim) mengikat, dan yang lainnya dikenal sebagai situs alosterik, yang spesifik untuk metabolit lain.
“Metabolit lain” ini disebut efektor alosterik dan dapat memiliki efek positif atau negatif pada laju reaksi yang dikatalisis enzim atau afinitas yang mengikatnya dengan substratnya di situs aktif.
Biasanya, pengikatan efektor ke situs alosterik enzim menyebabkan efek di situs lain dari struktur, memodifikasi aktivitas atau kinerja fungsionalnya.
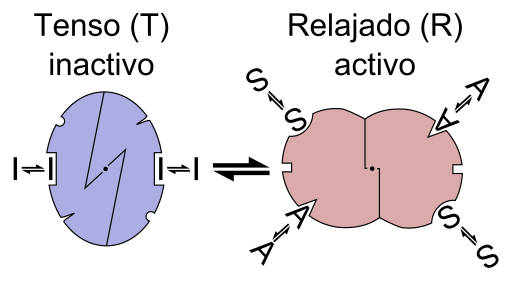
Skema grafik reaksi enzim alosterik (Sumber: Berkas: Enzyme allostery en.png: Berkas: Enzyme allostery.png: Allostery.png: Nicolas Le Novere (bicara). Lenov di en.wikipedia karya turunan: TimVickers (berbicara) turunan karya: Retama (bicara) karya turunan: KES47 [CC BY-SA (https://creativecommons.org/licenses/by-sa/3.0) Via Wikimedia Commons)
Dengan kata lain, pengikatan efektor alosterik ke situs spesifiknya dalam struktur enzim menyebabkan perubahan geometri molekul enzim, yang dikenal sebagai transisi alosterik, yaitu peristiwa yang ditransmisikan ke seluruh makromolekul, memodifikasi perilakunya.
Alosterisme dapat bersifat homotropik atau heterotropik. Proses regulasi alosterik homotropik didefinisikan sebagai proses di mana substrat yang sama dari suatu enzim bertindak sebagai regulator alosteriknya, yaitu, efektor alosterik adalah substrat yang sama; itu juga dikenal sebagai jenis kerja sama.
Proses regulasi heterotropik, di sisi lain, mengacu pada regulasi aktivitas enzim yang dimediasi oleh molekul alosterik atau efektor yang berbeda dari substratnya, dan juga dapat memiliki efek positif atau negatif pada aktivitas enzim.
Fitur
Allosterisme, bersama dengan regulasi ekspresi gen, translasi, dan degradasi protein, adalah salah satu mekanisme fundamental untuk regulasi sejumlah besar proses organik, yang penting untuk pemeliharaan homeostasis dan untuk kelangsungan hidup semua makhluk hidup, uniseluler atau multiseluler.
Regulasi alosterik atau allosterisme memberi organisme hidup kemampuan untuk merespons dengan sangat sensitif terhadap perubahan konsentrasi ligan pengatur, serta memunculkan fenomena ritmik pada tingkat sel.
Karena energi dan substrat metabolik terbatas dalam sel, alosterisme memungkinkan, di bidang metabolisme, penggunaan sumber daya secara cararat, menghindari siklus yang tidak berguna dan pemborosan energi untuk pemrosesan substrat yang berlebihan dalam kondisi berlimpah atau kelangkaan.
Dengan cara yang sama, mekanisme pengaturan ini sangat penting untuk proses pensinyalan sel, di mana banyak perubahan konformasi terlibat yang dipicu oleh pengikatan ligan yang berbeda di situs spesifik reseptor yang bersangkutan.
Contoh-contoh Alosterisme
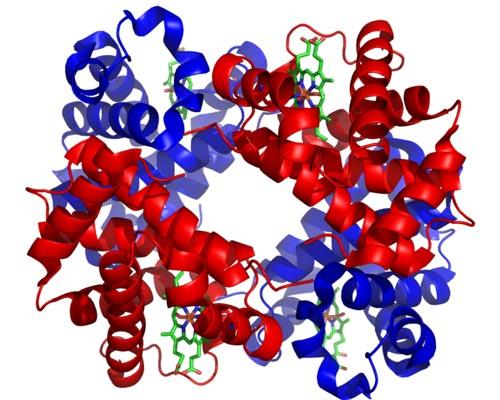
Hemoglobin. Diambil dan diedit dari: Zephyris di Wikipedia bahasa Inggris [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)].
Meskipun ada ribuan contoh alosterik atau regulasi alosterik di alam, beberapa di antaranya lebih menonjol daripada yang lain. Seperti halnya hemoglobin, yang merupakan salah satu protein pertama yang dijelaskan secara mendalam dalam aspek struktural.
Hemoglobin adalah protein yang sangat penting bagi banyak hewan, karena bertanggung jawab untuk pengangkutan oksigen melalui darah dari paru-paru ke jaringan. Protein ini menyajikan regulasi alosterik homotropik dan heterotropik secara bersamaan.
Alosterisme homotropik hemoglobin berkaitan dengan fakta bahwa pengikatan molekul oksigen ke salah satu subunit yang menyusunnya secara langsung mempengaruhi afinitas dengan mana subunit yang berdekatan mengikat molekul oksigen lain, meningkatkannya (regulasi positif atau kooperativisme).
Alosterisme heterotropik
Alosterisme heterotropik, di sisi lain, terkait dengan efek yang dimiliki pH dan keberadaan 2,3-difosfogliserat pada pengikatan oksigen ke subunit enzim ini, menghambatnya.
Aspartat transcarbamylase atau ATCase, yang berpartisipasi dalam jalur sintesis pirimidin, juga merupakan salah satu contoh “klasik” dari regulasi alosterik. Enzim ini, yang memiliki 12 subunit, 6 di antaranya aktif secara katalitik dan 6 bersifat regulasi, dihambat secara heterotropik oleh produk akhir dari jalur yang dipimpinnya, cytidine triphosphate (CTP).
Operon laktosa dari E. coli
Buah dari gagasan pertama Monod, Jacob dan Changeux adalah sebuah artikel yang diterbitkan oleh Jacob dan Monod terkait dengan operon laktosa Escherichia colii , yang merupakan salah satu contoh khas regulasi alosterik heterotropik pada tingkat genetik.
Regulasi alosterik dari sistem ini tidak terkait dengan kemampuan untuk mengubah substrat menjadi produk, tetapi dengan afinitas pengikatan protein ke wilayah DNA operator.
Referensi
- Changeux, JP, & Edelstein, SJ (2005). Mekanisme alosterik transduksi sinyal. Sains, 308 (5727), 1424-1428.
- Goldbeter, A., & Dupont, G. (1990). Regulasi alosterik, kooperativitas, dan osilasi biokimia. Kimia biofisik, 37 (1-3), 341-353.
- Jiao, W., & Parker, EJ (2012). Menggunakan kombinasi teknik komputasi dan eksperimental untuk memahami dasar molekuler untuk alosterik protein. Dalam Kemajuan dalam kimia protein dan biologi struktural (Vol. 87, hlm. 391-413). Pers Akademik.
- Kern, D., & Zuiderweg, ER (2003). Peran dinamika dalam regulasi alosterik. Pendapat terkini dalam biologi struktural, 13 (6), 748-757.
- Laskowski, RA, Gerick, F., & Thornton, JM (2009). Dasar struktural regulasi alosterik dalam protein. Surat FEBS, 583 (11), 1692-1698.
- Mathews, CK, Van Holde, KE, & Ahern, KG (2000). Biokimia, ed. San Fransisco, California

