prolin (Pro, P) milik 22 asam amino diklasifikasikan sebagai dasar. Ini adalah asam amino non-esensial, karena dapat disintesis oleh manusia dan hewan mamalia lainnya.
Pada tahun 1900, ilmuwan Jerman Richard Willstatter adalah orang pertama yang mengekstrak dan mengamati prolin. Namun, Emili Fischer, pada tahun 1901, yang menciptakan istilah “prolin” berdasarkan cincin pirolidin dari asam amino; Peneliti ini juga berhasil menjelaskan secara detail sintesis prolin dari kasein susu.
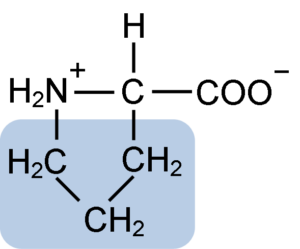
Struktur kimia asam amino Prolin (Sumber: Clavecin [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Dalam protein seperti kasein, prolin memainkan peran penting dalam “liku-liku” dan lipatan struktural. Dalam protein ini, prolin didistribusikan secara homogen ke seluruh struktur dan berikatan dengan protein -kasein dan s1; lebih jauh lagi, ini mencegah terbentuknya belokan atau loop struktural yang salah.
Dalam analisis biokimia yang biasa digunakan untuk menentukan urutan yang tepat dari asam amino yang menyusun protein, prolin adalah salah satu asam amino yang paling sulit untuk dideteksi, karena gugus amino sekunder dari prolin memiliki perilaku yang berbeda dan tidak dapat dengan mudah dideteksi.
Scurvy mungkin adalah penyakit paling terkenal yang berhubungan dengan prolin. Hal ini berkaitan dengan kekurangan asupan vitamin C yang secara langsung mempengaruhi hidroksilasi prolin pada serat kolagen sehingga menyebabkan pelemahan sistemik akibat ketidakstabilan serat kolagen yang ada di seluruh tubuh.
Indeks artikel
Karakteristik
Gugus amino sekunder yang melekat pada -karbon membuat tugas mengklasifikasikan prolin agak sulit. Namun, dalam beberapa teks diklasifikasikan bersama dengan asam amino bercabang atau dengan rantai samping alifatik, karena rantai samping atau gugus R prolin bersifat hidrofobik atau alifatik.
Salah satu karakteristik yang paling penting dari prolin adalah bahwa dalam kasus apa pun ia tidak dapat membentuk ikatan hidrogen, yang membuatnya ideal untuk menyusun belokan kompleks dan rumit dalam struktur tersier protein.
Sama seperti semua asam amino memiliki dua isoform yang bergantung pada atom karbon pusat, prolin dapat ditemukan di alam sebagai L-prolin atau sebagai D-prolin. Namun, bentuk L-prolin adalah yang paling melimpah di alam dan merupakan bagian dari struktur protein.
Dalam protein tempat ia ditemukan, prolin sering menempati tempat yang dekat dengan permukaan atau ke lipatan atau situs “pelintir” rantai polipeptida, karena struktur prolin yang kaku dan tertutup membuat interaksi yang kuat dengan asam amino lain menjadi sulit.
Struktur
Prolin memiliki struktur tertentu di antara asam amino basa, karena memiliki gugus amino sekunder (NH2) dan bukan gugus amino primer yang merupakan karakteristik semua asam amino.
Gugus R atau rantai samping prolin adalah cincin pirolidin atau tetrahidropirol. Gugus ini dibentuk oleh amina heterosiklik (tanpa ikatan rangkap) dari lima atom karbon, di mana masing-masing dijenuhkan dengan atom hidrogen.
Prolin memiliki kekhasan bahwa atom karbon “pusat” termasuk dalam cincin heterosiklik pirolidin, sehingga satu-satunya atom “bebas” atau “menonjol” adalah gugus karboksil (COOH) dan atom hidrogen (H ) dari cincin heterosiklik dari Asam amino.
Rumus molekul prolin adalah C5H9NO2 dan nama IUPAC-nya adalah asam pirolidin-2-karboksilat. Ini memiliki berat molekul perkiraan 115,13 g / mol dan frekuensi kemunculannya dalam protein sekitar 7%.
Fitur
Serat kolagen dan tropokolagen adalah protein yang paling melimpah di sebagian besar hewan vertebrata . Ini membentuk kulit, tendon, matriks tulang, dan banyak jaringan lainnya.
Serat kolagen terdiri dari banyak heliks tiga polipeptida berulang yang, pada gilirannya, terdiri dari beberapa residu prolin dan glisin dalam urutan glisin-prolin-prolin / hidroksiprolin (yang terakhir adalah turunan prolin yang dimodifikasi).
Dalam bentuk aslinya, prolin adalah bagian dari prokolagen, ini menjadi prekursor polipeptida kolagen dan beberapa protein jaringan ikat lainnya. Enzim prokolagen prolin hidroksilase bertanggung jawab untuk menghidroksilasi residu prolin menjadi hidroksiprolin dan dengan demikian mencapai pematangan prokolagen menjadi kolagen itu sendiri.
Apa fungsi utama prolin dalam serat kolagen?
Hidroksiprolin memberikan karakteristik ketahanan terhadap kolagen, karena turunan asam amino ini memiliki kemampuan untuk membentuk sejumlah besar ikatan hidrogen antara rantai triple helix yang membentuk protein.
Enzim yang mengkatalisis hidroksilasi residu prolin memerlukan adanya vitamin C (asam askorbat) dan, seperti disebutkan sebelumnya, penyakit kudis disebabkan oleh melemahnya serat kolagen karena kegagalan hidroksilasi residu prolin. ikatan hidrogen yang menahan serat kolagen.
Fungsi lainnya
Prolin sangat penting untuk pembentukan lipatan dan lilitan protein.
Strukturnya yang tertutup membuat asam amino ini sulit untuk “mengakomodasi” di dalam protein, selain itu, karena tidak dapat membentuk ikatan hidrogen untuk “berinteraksi” dengan residu terdekat lainnya, ia menginduksi pembentukan “putaran” atau “liku” di seluruh struktur protein di mana itu ditemukan.
Semua protein berumur pendek memiliki setidaknya satu wilayah dengan pengulangan prolin, glutamat, serin, dan treonin yang melimpah. Daerah ini berkisar dari 12 hingga 60 residu dan disebut urutan PEST.
Protein yang mengandung urutan PEST ditandai dengan ubiquitinasi untuk degradasi selanjutnya dalam proteasom.
Biosintesis
Banyak asam amino dapat disintesis dari zat antara dalam glikolisis, jalur pentosa fosfat, atau siklus asam sitrat (siklus Krebs). Prolin dan arginin dibentuk dalam jalur glutamat pendek.
Jalur biosintetik yang hampir umum untuk semua organisme hidup dimulai dengan konversi L-glutamat menjadi -L-glutamil-5-fosfat berkat aksi enzim glutamat-5-kinase (dalam bakteri) atau oleh -glutamil-kinase (pada manusia).
Reaksi ini melibatkan fosforilasi yang bergantung pada ATP dimana, selain produk utama, molekul ADP dihasilkan.
Reaksi yang dikatalisis oleh glutamat 5-semialdehid dehidrogenase (pada bakteri) atau oleh -glutamil fosfat reduktase (pada manusia) mengubah -L-glutamil-5-fosfat menjadi L-glutamat-5-semialdehida dan reaksi ini memerlukan kehadiran kofaktor NADPH.
L-glutamat-5-semialdehida secara reversibel dan spontan didehidrasi menjadi (S) -1-1-pirolin-5-karboksilat, yang kemudian diubah menjadi L-prolin oleh enzim pirolin-5-karboksilat reduktase (pada bakteri dan manusia ) , yang dalam reaksinya molekul NADPH atau NADH juga diperlukan.
Degradasi
Prolin, arginin, glutamin, dan histidin secara konstan terdegradasi menjadi -ketoglutarat untuk memasuki siklus asam sitrat atau siklus Krebs. Dalam kasus tertentu prolin, pertama kali dioksidasi oleh enzim prolin oksidase menjadi pirolin-5-karboksilat.
Pada langkah pertama, di mana oksidasi prolin menjadi pirolin-5-karboksilat terjadi, proton yang terlepas diterima oleh E-FAD, direduksi menjadi E-FADH2; langkah ini unik untuk asam amino prolin.
Dengan reaksi spontan, pirolin-5-karboksilat diubah menjadi glutamat -semialdehida, yang kemudian berfungsi sebagai substrat untuk enzim glutamat -semialdehid dehidrogenase. Pada langkah ini, dua proton dilepaskan, salah satunya diterima oleh NAD, yang direduksi menjadi NADH, dan yang lainnya bebas dalam bentuk H +.
Arginin, seperti prolin, diubah menjadi -semialdehida glutamat, tetapi melalui jalur metabolisme alternatif yang melibatkan dua enzim yang berbeda.
Enzim glutamat -semialdehid dehidrogenase mengubah glutamat -semialdehida menjadi L-glutamat. Selanjutnya, L-glutamat ini dioksidasi lagi oleh enzim glutamat dehidrogenase, yang akhirnya membentuk -ketoglutarat, yang akan dimasukkan ke dalam siklus asam sitrat.
Pada langkah oksidasi glutamat, sebuah proton (H +) dan gugus amino (NH3 +) dilepaskan. Proton mereduksi gugus NADP + dan molekul NADPH terbentuk.
Terlepas dari banyak kesamaan yang ada antara jalur degradasi dan biosintesis prolin dan arginin, asam amino ini disintesis dan didegradasi oleh jalur yang benar-benar berlawanan menggunakan enzim yang berbeda, kofaktor yang berbeda, dan kompartemen intraseluler yang berbeda.
Makanan kaya valin
Secara umum, semua makanan berprotein tinggi memiliki prolin dalam jumlah besar. Ini termasuk daging, susu, telur, dan lain-lain. Namun, ketika tubuh kita dalam kondisi kesehatan dan nutrisi yang optimal, ia mampu mensintesis prolin secara endogen.
Prolin juga dapat ditemukan di banyak kacang-kacangan dan kacang-kacangan dan biji-bijian seperti gandum, misalnya. Makanan lain yang kaya prolin antara lain dedak gandum, kenari, almond, kacang polong, dan buncis.
Beberapa toko makanan kesehatan sering memformulasi tablet asam amino L-lisin dan L-prolin yang digabungkan untuk membantu orang dengan masalah persendian atau memperlambat penuaan jaringan.
Namun, belum terbukti dengan pasti bahwa mengonsumsi suplemen makanan dari asam amino ini memiliki efek yang signifikan pada penundaan usia tua atau kondisi lain yang khas dari usia lanjut.
Manfaat asupannya
Diet kaya prolin biasanya diresepkan untuk orang dengan penyakit sendi seperti radang sendi, keseleo, robekan ligamen, dislokasi, tendinitis dan lain-lain, dan ini karena hubungannya dengan sintesis serat kolagen yang ada di jaringan ikat tubuh.
Banyak losion dan tablet farmakologis yang digunakan dalam industri estetika diperkaya dengan L-prolin, karena beberapa penelitian telah menunjukkan bahwa asam amino ini dalam beberapa cara dapat meningkatkan sintesis kolagen dan, oleh karena itu, memperbaiki tekstur kulit, mempercepat penyembuhan luka, laserasi. , borok dan luka bakar.
Dalam industri makanan ada protein yang memiliki “peptida bioaktif” yang berolahraga lebih dari sifat nutrisinya. Peptida ini umumnya memiliki dua hingga sembilan residu asam amino, termasuk prolin, arginin, dan lisin.
Peptida bioaktif tersebut dapat memiliki aktivitas antihipertensi dengan efek opioid tertentu; mereka dapat bertindak sebagai imunomodulator dengan merangsang respon imun terhadap beberapa patogen dan bahkan dapat menyebabkan peningkatan vasoaktivitas, yang meningkatkan peredaran mereka yang mengkonsumsinya.
Gangguan kekurangan
Gluten adalah protein yang ada dalam biji-bijian gandum yang menyebabkan radang usus. Orang dengan “intoleransi gluten” dikenal sebagai pasien “celiac” dan protein ini dikenal kaya akan prolin dan glutamin, degradasi proteolitik yang sulit bagi orang dengan kondisi ini.
Beberapa penyakit berkaitan dengan kesalahan lipatan protein penting dan sangat umum bahwa cacat ini berkaitan dengan isomerisasi cis – trans dari ikatan amida dalam residu prolin, karena, tidak seperti ikatan peptida lain di mana isomer trans sangat tinggi. disukai, di prolin itu kurang diuntungkan.
Dalam residu prolin, telah diamati bahwa ada kecenderungan yang signifikan terhadap pembentukan isomer cis pertama daripada isomer trans dalam amida yang berdekatan dengan residu prolin, yang dapat menghasilkan konformasi protein yang “salah”.
Gangguan metabolisme
Seperti asam amino esensial dan non-esensial lainnya, gangguan patologis utama yang terkait dengan prolin biasanya terkait dengan cacat pada rute asimilasi asam amino ini.
Hiperprolinemia, misalnya, adalah kasus khas defisiensi salah satu enzim yang berpartisipasi dalam jalur degradasi prolin, khususnya 1-pirolina-5-karboksilat dehidrogenase, yang menyebabkan akumulasi substratnya, yang akhirnya menonaktifkan rute tersebut.
Patologi ini biasanya didiagnosis dengan kandungan prolin yang tinggi dalam plasma darah dan dengan adanya metabolit 1-pirolin-5-karboksilat dalam urin pasien yang terkena.
Gejala utama penyakit ini terdiri dari gangguan saraf, penyakit ginjal dan gangguan pendengaran atau tuli. Kasus lain yang lebih parah termasuk keterbelakangan mental yang parah dan kesulitan psikomotor yang nyata.
Referensi
- Abu-Baker, S. (2015). Tinjauan Biokimia: Konsep dan Koneksi
- Delauney, AJ, & Verma, DPS (1993). Biosintesis dan osmoregulasi prolin pada tumbuhan. Jurnal tanaman, 4 (2), 215-223.
- Daftar, B., Lerner, RA, & Barbas, CF (2000). Reaksi aldol asimetris langsung yang dikatalisis prolin. Jurnal American Chemical Society, 122 (10), 2395-2396
- Nelson, DL, Lehninger, AL, & Cox, MM (2008). Prinsip biokimia Lehninger. Macmillan.
- Plimmer, RHA (1912). Konstitusi kimia protein (Vol. 1). Longman, Hijau.
- Szabados, L., & Savouré, A. (2010). Prolin: asam amino multifungsi. Tren dalam ilmu tanaman, 15 (2), 89-97.

