isoleusin (Ile, I) adalah salah satu dari 22 alami asam amino sebagai bagian dari protein. Karena tubuh manusia, seperti beberapa mamalia lain, tidak dapat mensintesisnya, isoleusin adalah salah satu dari 9 asam amino esensial yang harus diperoleh dari makanan.
Asam amino ini diisolasi untuk pertama kalinya pada tahun 1903 oleh ilmuwan F. Ehrlich dari konstituen nitrogen dari bit atau molase bit. Kemudian, penulis yang sama memisahkan isoleusin dari produk dekomposisi fibrin dan protein lain.
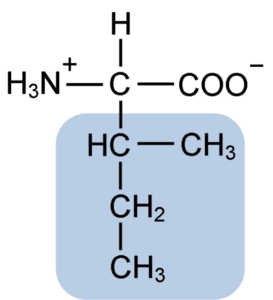
Struktur kimia asam amino Isoleusin (Sumber: Clavecin [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Ini adalah asam amino non-polar yang ada di sebagian besar protein seluler organisme hidup, selain itu, ini adalah bagian dari kelompok asam amino rantai cabang BCAA ( Asam Amino Rantai Cabang ), bersama dengan leusin dan valin.
Ini memiliki fungsi dalam pembentukan struktur tersier banyak protein dan, di samping itu, berpartisipasi dalam pembentukan berbagai prekursor metabolisme yang terkait dengan metabolisme energi seluler.
Indeks artikel
Karakteristik
Isoleusin diklasifikasikan dalam kelompok asam amino nonpolar dengan gugus R atau rantai yang bersifat alifatik, yaitu dengan rantai hidrokarbon hidrofobik.
Karena karakteristik ini, asam amino dari kelompok ini seperti alanin, valin dan leusin, cenderung tetap dekat satu sama lain, yang berkontribusi pada stabilisasi protein di mana mereka menjadi bagian melalui interaksi hidrofobik.
Asam amino non-polar ini beratnya sekitar 131 g / mol dan hadir dalam protein dalam proporsi yang mendekati 6%, sering “terkubur” di tengahnya (berkat kualitas hidrofobiknya).
Struktur
Isoleusin adalah asam -amino yang, seperti asam amino lainnya, memiliki atom karbon pusat yang disebut -karbon (yang kiral), yang melekat pada empat kelompok berbeda: atom hidrogen, gugus amino (-NH2), gugus karboksil (-COOH) dan rantai samping atau gugus R.
Gugus R isoleusin terdiri dari hidrokarbon bercabang tunggal dari 4 atom karbon (-CH3-CH2-CH (CH3)) yang rantainya juga terdapat atom karbon kiral.
Karena karakteristik ini, isoleusin memiliki empat kemungkinan bentuk: dua di antaranya adalah isomer optik yang dikenal sebagai L-isoleusin dan D-isoleusin dan dua lainnya adalah diastereoisomer L-isoleusin. Bentuk dominan dalam protein adalah L-isoleusin.
Rumus molekul isoleusin adalah C6H13NO2 dan nama kimianya adalah asam -amino-β-metil-β-etilpropionat atau asam 2-amino-3-metil pentatonik.
Fitur
Isoleusin memiliki beberapa fungsi fisiologis pada hewan, termasuk:
– Penyembuhan luka
– Detoksifikasi limbah nitrogen
– Stimulasi fungsi kekebalan tubuh dan
– Promosi sekresi hormon yang berbeda.
Ini dianggap sebagai asam amino glukogenik, karena berfungsi sebagai molekul prekursor untuk sintesis zat antara siklus asam sitrat (siklus Krebs) yang kemudian berkontribusi pada pembentukan glukosa di hati.
Untuk alasan ini, isoleusin diyakini berpartisipasi dalam pengaturan kadar glukosa plasma, yang memiliki implikasi penting dari sudut pandang energi tubuh.
Isoleusin berkontribusi pada jalur sintesis glutamin dan alanin, bekerja demi keseimbangan antara asam amino rantai cabang.
Dalam pengaturan klinis, beberapa penulis menunjukkan bahwa peningkatan konsentrasi isoleusin, leusin, tirosin dan valin mungkin merupakan penanda karakteristik sel yang terkena tumor, diikuti oleh peningkatan kadar glutamin.
Fungsi lainnya
Penyelidikan ilmiah yang berbeda telah menunjukkan bahwa isoleusin diperlukan untuk sintesis hemoglobin, protein yang bertanggung jawab untuk mengangkut oksigen dalam darah banyak hewan.
Selain itu, asam amino ini mengaktifkan masuknya nutrisi ke dalam sel; Beberapa penelitian mengungkapkan bahwa selama puasa berkepanjangan mampu menggantikan glukosa sebagai sumber energi dan, di samping itu, adalah asam amino ketogenik.
Asam amino ketogenik adalah asam amino yang kerangka karbonnya dapat disimpan sebagai asam lemak atau karbohidrat, sehingga berfungsi sebagai cadangan energi.
Isoleusin dan asam amino rantai cabang lainnya (selain faktor pertumbuhan dan kondisi lingkungan) bekerja pada aktivasi jalur sinyal target Rapamycin, mTOR ( Target Mekanistik Rapamycin ).
Jalur ini merupakan jalur pensinyalan penting pada eukariota yang mampu mengendalikan pertumbuhan dan metabolisme sel, serta sintesis protein dan peristiwa autophagy. Selain itu, ia mengontrol kemajuan penuaan dan beberapa patologi seperti kanker atau diabetes.
Biosintesis
Manusia dan hewan lain tidak dapat mensintesis isoleusin, tetapi ini adalah bagian dari protein seluler berkat perolehannya dari makanan yang kita konsumsi setiap hari.
tanaman , jamur dan mikroorganisme mampu mensintesis asam amino ini dari rute agak rumit itu, pada umumnya, saling berhubungan dengan asam amino lainnya juga dianggap penting bagi manusia.
Ada, misalnya, jalur untuk produksi isoleusin, lisin, metionin, dan treonin dari aspartat.
Pada bakteri, khususnya, isoleusin diproduksi dari asam amino treonin, melalui piruvat, melalui jalur yang melibatkan kondensasi 2 karbon piruvat dengan molekul -ketobutirat yang berasal dari treonin.
Reaksi dimulai dengan aksi enzim treonin dehidratase, yang mengkatalisis dehidrasi treonin untuk menghasilkan -ketobutirat dan amonium (NH3). Selanjutnya, enzim yang sama yang berpartisipasi dalam biosintesis valin berkontribusi pada langkah-langkah
– Transaminasi
– Dekarboksilasi oksidatif dari asam keto yang sesuai dan
– Dehidrogenasi.
Dalam jenis mikroorganisme ini, sintesis asam amino seperti lisin, metionin, treonin dan isoleusin sangat terkoordinasi dan diatur, terutama oleh umpan balik negatif, di mana produk reaksi menghambat aktivitas enzim yang terlibat.
Terlepas dari kenyataan bahwa isoleusin, seperti leusin dan valin, adalah asam amino esensial bagi manusia, enzim aminotransferase yang ada di jaringan tubuh dapat secara reversibel mengubahnya menjadi asam -keto yang sesuai, yang pada akhirnya dapat menggantikannya dalam makanan.
Degradasi
Seperti banyak asam amino yang dikenal di alam, isoleusin dapat didegradasi untuk membentuk perantara jalur metabolisme yang berbeda, di antaranya siklus Krebs menonjol (yang menyediakan jumlah terbesar koenzim yang bekerja untuk produksi energi atau untuk biosintesis. senyawa lain).
Isoleusin, triptofan, lisin, fenilalanin, tirosin, treonin, dan leusin semuanya dapat digunakan untuk memproduksi asetil-KoA, zat antara metabolisme utama untuk berbagai reaksi seluler.
Tidak seperti asam amino lainnya, asam amino rantai cabang (leusin, isoleusin, dan valin) tidak terdegradasi di hati, tetapi dioksidasi sebagai bahan bakar di otot, otak, ginjal, dan jaringan adiposa.
Organ dan jaringan ini dapat menggunakan asam amino ini berkat adanya enzim aminotransferase yang mampu bekerja pada ketiganya dan menghasilkan asam amino -keto yang sesuai.
Setelah turunan asam amino teroksidasi ini diproduksi, kompleks enzim dehidrogenase asam -keto mengkatalisis dekarboksilasi oksidatifnya, di mana ia melepaskan molekul karbon dioksida (CO2) dan menghasilkan turunan asil-KoA dari asam amino yang bersangkutan.
Patologi yang berhubungan dengan metabolisme isoleusin
Cacat metabolisme isoleusin dan asam amino lainnya dapat menyebabkan berbagai patologi yang aneh dan kompleks seperti, misalnya, penyakit ” Urin Sirup Maple ” (urin dengan bau sirup maple) atau ketoasiduria rantai bercabang.
Sesuai namanya, penyakit ini ditandai dengan aroma khas urin penderitanya, serta muntah-muntah, kejang, keterbelakangan mental dan kematian dini.
Ini harus dilakukan, khususnya, dengan kesalahan dalam kompleks enzim -ketoacid dehydrogenase, yang dengannya asam amino rantai cabang seperti isoleusin dan turunannya yang teroksidasi diekskresikan dalam urin.
Secara kolektif, patologi yang berhubungan dengan katabolisme asam amino rantai cabang seperti isoleusin dikenal sebagai acidurias organik, meskipun yang berhubungan langsung dengan asam amino ini cukup jarang.
Makanan kaya isoleusin
Asam amino ini berlimpah di jaringan otot hewan, itulah sebabnya daging hewan seperti daging sapi, babi, ikan dan yang serupa lainnya seperti domba, ayam, kalkun, daging rusa, antara lain, mereka kaya akan itu.
Itu juga ditemukan dalam produk susu dan turunannya seperti keju. Itu ada dalam telur dan juga dalam berbagai jenis biji-bijian dan kacang-kacangan, sebagai bagian penting dari protein yang membentuknya.
Ini berlimpah dalam kedelai dan kacang polong, serta ekstrak ragi yang digunakan untuk berbagai keperluan nutrisi.
Tingkat plasma isoleusin untuk manusia dewasa adalah antara 30 dan 108 mol / l, untuk anak-anak dan remaja antara 2 dan 18 tahun antara 22 dan 107 mol / l dan untuk bayi antara 0 dan 2 tahun mereka kira-kira antara 26 dan 86 mol / l.
Data ini menunjukkan bahwa konsumsi makanan yang kaya akan asam amino ini dan asam amino terkait lainnya diperlukan untuk pemeliharaan banyak fungsi fisiologis organisme, karena manusia tidak mampu mensintesisnya secara de novo .
Manfaat asupannya
Suplemen nutrisi isoleusin biasanya mengandung asam amino rantai cabang esensial lainnya seperti valin atau leusin atau lainnya.
Di antara contoh konsumsi isoleusin yang paling umum adalah suplemen nutrisi yang digunakan oleh atlet untuk meningkatkan persentase massa otot atau sintesis protein. Namun, dasar ilmiah yang mendukung praktik ini terus diperdebatkan, dan hasilnya tidak sepenuhnya dijamin.
Isoleusin, bagaimanapun, digunakan untuk melawan efek metabolik dari defisiensi vitamin (pelagra) karakteristik pasien yang memiliki diet kaya sorgum dan jagung, yang merupakan makanan tinggi leusin, yang dapat mempengaruhi metabolisme triptofan dan asam nikotinat pada manusia.
Efek pellagra pada tikus percobaan, misalnya, melibatkan keterlambatan pertumbuhan, yang diatasi dengan suplementasi isoleusin.
– Dalam industri produksi hewan
Di bidang produksi hewan, asam amino seperti lisin, treonin, metionin, dan isoleusin telah digunakan dalam uji percontohan untuk memberi makan babi yang tumbuh dalam kondisi terkendali.
Isoleusin, khususnya, tampaknya memiliki efek pada asimilasi nitrogen, meskipun tidak berkontribusi pada penambahan berat badan pada hewan ternak ini.
– Dalam beberapa kondisi klinis
Beberapa publikasi menunjukkan bahwa isoleusin mampu menurunkan kadar glukosa plasma, sehingga asupannya dianjurkan pada pasien yang menderita kelainan seperti diabetes atau tingkat produksi insulin yang rendah.
Infeksi virus
Suplementasi isoleusin telah terbukti bermanfaat pada pasien yang terinfeksi rotavirus yang menyebabkan penyakit seperti gastroenteritis dan diare pada anak kecil dan hewan muda lainnya.
Studi terbaru menyimpulkan bahwa konsumsi asam amino ini oleh hewan percobaan dengan karakteristik yang disebutkan (terinfeksi rotavirus) membantu dalam pertumbuhan dan kinerja sistem kekebalan bawaan berkat aktivasi jalur sinyal PRR atau reseptor dengan pengenalan pola.
Gangguan kekurangan
Kekurangan isoleusin dapat menyebabkan masalah dengan penglihatan, kulit (seperti dermatitis), dan usus (jelas seperti diare dan manifestasi gastrointestinal lainnya).
Karena merupakan asam amino esensial untuk pembentukan dan sintesis hemoglobin, serta untuk regenerasi eritrosit (sel darah), defisiensi isoleusin yang parah dapat memiliki konsekuensi fisiologis yang serius, terutama yang berkaitan dengan anemia dan penyakit hematologi lainnya. .
Hal ini telah dibuktikan secara eksperimental pada hewan pengerat “normal” yang telah diberi diet yang buruk dalam isoleusin ini, yang berakhir dengan perkembangan kondisi anemia yang signifikan.
Namun, isoleusin berpartisipasi dalam pembentukan hemoglobin hanya pada bayi, karena protein manusia dewasa tidak memiliki sejumlah besar asam amino tersebut; ini berarti bahwa defisiensi isoleusin paling jelas terlihat selama tahap awal perkembangan.
Referensi
- Aders Plimmer, R. (1908). Konstitusi Kimia Protein. Bagian I. London, Inggris: Longmans, Green, dan CO.
- Aders Plimmer, R. (1908). Konstitusi Kimia Protein. Bagian II. London, Inggris: Longmans, Green, dan CO.
- Barret, G., & Elmore, D. (2004). Asam Amino dan Peptida . Cambridge: Pers Universitas Cambridge.
- Blau, N., Duran, M., Blaskovics, M., & Gibson, K. (1996). Panduan Dokter untuk Diagnosis Laboratorium Penyakit Metabolik (Edisi ke-2).
- Bradford, H. (1931). Sejarah Penemuan Asam Amino. II. Tinjauan Asam Amino Digambarkan Sejak 1931 sebagai Komponen Protein Asli. Kemajuan dalam Kimia Protein , 81-171.
- Campos-Ferraz, PL, Bozza, T., Nicastro, H., & Lancha, AH (2013). Efek berbeda dari suplementasi leusin atau campuran asam amino rantai cabang (leusin, isoleusin, dan valin) pada ketahanan terhadap kelelahan, dan degradasi otot dan glikogen hati, pada tikus terlatih. Nutrisi , 29 (11-12), 1388-1394.
- Champe, P., & Harvey, R. (2003). Asam Amino Asam Amino. Dalam Illustrated Reviews Lippincott: Biochemistry (edisi ke-3., Hal. 1–12). Lippincott.
- Chandran, K., & Damodaran, M. (1951). Asam Amino dan Protein dalam Pembentukan Hemoglobin 2. Isoleusin. Jurnal Biokimia , 49 , 393-398.
- Chung, AS, & Beames, RM (1974). Suplementasi Lisin, Treonin, Metionin, dan Isoleusin dari Jelai Sungai Perdamaian untuk Babi yang Tumbuh. Anjing. J.Anim. Sci. , 436 , 429-436.
- Dejong, C., Meijerink, W., van Berlo, C., Deutz, N., & Soeters, P. (1996). Penurunan konsentrasi isoleusin plasma setelah perdarahan saluran cerna bagian atas pada manusia. Nyali , 39 , 13-17.
- Edsall, J. (1960). Asam Amino, Protein dan Biokimia Kanker (Vol. 241). London: Academic Press, Inc.
- Ensiklopedia Britannica. (2012). Diakses pada 30 Agustus 2019, dari https://www.britannica.com/science/isoleucine
- Gelfand, R., Hendler, R., & Sherwin, R. (1979). Diet Karbohidrat dan Metabolisme Protein Tertelan. Lancet , 65–68.
- Hudson, B. (1992). Biokimia protein makanan . Springer-Science + Media Bisnis, BV
- Knerr, I., Vockley, J., & Gibson, KM (2014). Gangguan Metabolisme Leusin, Isoleusin, dan Valin. Dalam N. Blau (Ed.), Panduan Dokter untuk Diagnosis, Perawatan, dan Tindak Lanjut Penyakit Metabolik yang Diwariskan (hlm. 103–141).
- Korman, SH (2006). Kesalahan bawaan degradasi isoleusin: Sebuah tinjauan. Genetika Molekuler dan Metabolisme , 89 (4), 289-299.
- Krishnaswamy, K., & Gopalan, C. (1971). Pengaruh Isoleusin pada Kulit dan Electroencephalogram di Pellagra. Lancet , 1167–1169.
- Martin, RE, & Kirk, K. (2007). Transportasi isoleusin nutrisi penting dalam eritrosit manusia yang terinfeksi parasit malaria Plasmodium falciparum. Darah , 109 (5), 2217–2224.
- Pusat Nasional Informasi Bioteknologi. Basis Data PubChem. l-Isoleucine, CID = 6306, https://pubchem.ncbi.nlm.nih.gov/compound/l-Isoleucine (diakses pada 31 Agustus 2019)
- Nuttall, FQ, Schweim, K., & Gannon, MC (2008). Pengaruh isoleusin oral dengan dan tanpa glukosa pada insulin, glukagon dan konsentrasi glukosa pada subyek non-diabetes. European E-Journal of Clinical Nutrition and Metabolism , 3 (4), 152-158.
- van Berlo, CLH, van de Bogaard, AEJM, van der Heijden, MAH, van Eijk, HMH, Janssen, MA, Bost, MCF, & Soeters, PB (1989). Apakah peningkatan pembebasan amonia setelah perdarahan di saluran pencernaan akibat tidak adanya isoleusin sama sekali dalam hemoglobin? Sebuah studi pada babi. Hepatologi , 10 (3), 315–323.
- Vickery, HB, & Schmidt, CLA (1931). Sejarah penemuan asam amino. Ulasan Kimia , 9 (2), 169-318.
- Wolfe, RR (2017). Asam amino rantai cabang dan sintesis protein otot pada manusia: mitos atau kenyataan? Jurnal Masyarakat Internasional Nutrisi Olahraga , 14 (1), 1-7.
- Wu, G. (2009). Asam amino: Metabolisme, fungsi, dan nutrisi. Asam Amino , 37 (1), 1–17.

