imunofluoresensi adalah teknik yang kuat immunostaining menggunakan antibodi terikat secara kovalen dengan molekul neon untuk mengidentifikasi target spesifik dalam sampel sel tetap ke sebuah dukungan yang solid.
Teknik ini melibatkan pengamatan mikroskopis dengan spesifisitas imunologis, sehingga memungkinkan untuk mengamati sel hidup atau mati yang dapat menunjukkan jumlah antigen yang sangat kecil. Ini banyak digunakan baik di bidang penelitian maupun dalam diagnosis klinis berbagai patologi.
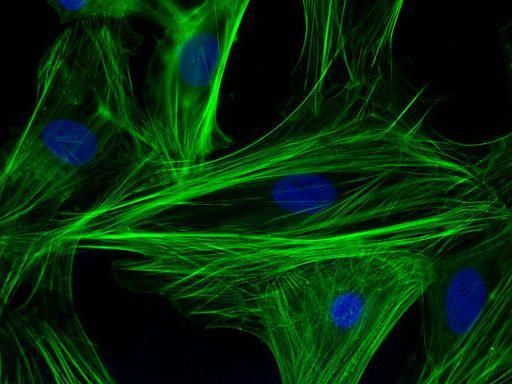
Imunostaining filamen aktin dalam sel kardiomiosit (Sumber: Ps1415 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Teknik ini, terutama kualitatif (dengan beberapa varian kuantitatif), berkaitan secara khusus dengan visualisasi sampel dengan sinyal produk fluorofor, yang merupakan molekul fluoresen yang terikat pada antibodi dan mampu tereksitasi pada panjang gelombang tertentu. .
Dalam konteks seluler, sangat berguna untuk mempelajari ada / tidaknya dan lokasi subseluler protein. Teknik ini awalnya digunakan dalam pengaturan klinis untuk diagnosis virus seperti influenza dan kemudian untuk banyak penyakit menular lainnya.
Ini adalah teknik yang sangat sensitif, dan dengan peralatan mikroskop yang sesuai, ia dapat memiliki resolusi yang sangat baik. Hal ini membutuhkan, untuk pengamatannya, penggunaan mikroskop confocal atau epifluorescence.
Namun, meskipun sangat populer, ini dapat menimbulkan beberapa masalah penting sehubungan dengan memperoleh fluoresensi nonspesifik yang menghasilkan beberapa “kebisingan” latar belakang, yang sering membatasi pembacaan hasil yang memadai.
Indeks artikel
Dasar
Imunofluoresensi didasarkan pada eksploitasi fenomena biologis dari reaksi interaksi antara antibodi dan antigen. Ini berkaitan secara khusus dengan visualisasi atau deteksi reaksi ini oleh molekul fluoresen yang menarik ke panjang gelombang tertentu.
Antibodi adalah protein imunoglobulin yang disekresikan dari sel B aktif, dan yang secara khusus dihasilkan melawan antigen, yang dapat diikat dengan afinitas dan spesifisitas yang tinggi. Imunofluoresensi memanfaatkan imunoglobulin IgG, yang larut dalam serum darah.
Antibodi adalah molekul hingga 950 kDa yang terdiri dari dua rantai peptida (berat) berbentuk “Y” pendek (ringan) dan dua panjang. Baik rantai ringan dan berat dibagi menjadi dua domain: satu variabel, mampu mengenali antigen, dan lainnya konstan atau kekal, karakteristik dari setiap spesies.
Antigen secara fungsional didefinisikan sebagai molekul yang dapat dikenali oleh antibodi dan sebagian besar merupakan protein. Ketika hewan terkena antigen, limfosit dari sistem kekebalan diaktifkan, menghasilkan antibodi spesifik terhadapnya dan berfungsi sebagai sistem pertahanan.
Antigen, seperti protein, misalnya, dapat memiliki lebih dari satu epitop atau situs pengenalan oleh antibodi, sehingga serum hewan yang terpapar antigen dapat memiliki antibodi poliklonal terhadap berbagai daerah dari protein yang sama.
Imunofluoresensi, kemudian, mengeksploitasi kemampuan hewan untuk menghasilkan antibodi poliklonal terhadap antigen tertentu untuk memurnikannya dan kemudian menggunakannya untuk mendeteksi antigen yang sama dalam konteks lain.
Di antara pewarna fluoresen atau molekul yang paling banyak digunakan untuk beberapa teknik imunofluoresensi adalah fluorescein isothiocyanate (FITC), tetramethylrhodamine isothiocyanate-5 dan 6 (TRITC), banyak sianin seperti Cy2, Cy3, Cy5 dan Cy7 dan pewarna yang disebut Alexa Fluor® , seperti Alexa Fluor®448.
Protokol
Protokol imunofluoresensi bervariasi tergantung pada banyak faktor, namun, secara umum, protokol ini mencakup urutan langkah linier yang terdiri dari:
- Slide dan persiapan sel
- Fiksasi sampel
- Permeabilisasi
- Pemblokiran
- Imunostaining atau imunostaining
- Perakitan dan observasi
-Persiapan
Dari sampel
Persiapan sampel akan tergantung pada sifat dan jenis pengalaman yang akan dilakukan. Kasus paling sederhana, yang melibatkan penggunaan sel dalam suspensi, akan dijelaskan di bawah ini.
Sel-sel dalam suspensi, yaitu, dalam media kultur cair, pertama-tama harus dipisahkan darinya dengan sentrifugasi dan kemudian harus dicuci dengan larutan buffer atau ” buffer ” isosmotik, yang menjaga integritasnya.
Biasanya, buffer fosfat-salin yang dikenal sebagai PBS digunakan, di mana sel-sel disuspensikan kembali dan campuran ini disentrifugasi lagi untuk mendapatkan sel-sel yang bebas dari media kultur, yang mungkin mengandung zat pengganggu.
Dari bilahnya
Slide yang digunakan untuk pengamatan mikroskopis, di mana sel-sel nantinya akan diperbaiki untuk perawatan hilir yang sesuai, juga harus disiapkan dengan hati-hati.
Ini ditutupi atau “peka” dengan larutan poli-lisin, polimer sintetik yang akan bertindak sebagai “lem molekul” antara sel dan penyangga padat, berkat interaksi elektrostatik antara muatan positif gugus aminonya dan muatan negatif pada protein yang melapisi sel.
Fiksasi sampel
Proses ini terdiri dari melumpuhkan protein yang ditemukan di dalam sel untuk menjaga lokasi spasial mereka tetap utuh. Molekul yang digunakan harus mampu melintasi semua jenis membran sel dan membentuk kisi-kisi dengan protein kovalen.
Formaldehida dan paraformaldehida, glutaraldehida dan bahkan metanol banyak digunakan, dengan sampel sel yang diinkubasi selama waktu tertentu dan kemudian dicuci dengan larutan buffer isosmotik.
Setelah memperbaiki sel, mereka terus menempel pada lembaran yang sebelumnya peka dengan poli-lisin.
Permeabilisasi
Bergantung pada jenis tes yang dilakukan, perlu atau tidaknya permeabilisasi sel-sel yang diteliti. Jika yang dicari adalah untuk mengetahui lokasi, ada tidaknya protein tertentu pada permukaan sel, permeabilisasi tidak diperlukan.
Di sisi lain, jika Anda ingin mengetahui lokasi protein di dalam sel, permeabilisasi sangat penting dan akan terdiri dari inkubasi sampel dengan Triton X-100, deterjen yang mampu menembus membran sel.
Pemblokiran
Langkah mendasar dalam semua teknik imunologi adalah pemblokiran. Pada tahap prosedur ini, pemblokiran terdiri dari menutupi, dalam lembaran peka, semua situs dengan molekul poli-lisin yang sel-selnya tidak menempel. Artinya, ini mencegah penyatuan nonspesifik.
Biasanya untuk larutan pemblokiran dengan bovine serum albumin (BSA) dalam buffer PBS digunakan dan hasil terbaik diperoleh semakin lama waktu inkubasi dengan larutan ini. Setelah setiap langkah, termasuk pemblokiran, perlu untuk membersihkan sisa larutan.
Imunostaining atau imunostaining
Prosedur immunostaining atau immunostaining akan tergantung terutama pada apakah itu imunofluoresensi langsung atau tidak langsung (lihat di bawah).
Jika itu adalah imunofluoresensi primer atau langsung, sampel akan diinkubasi dengan antibodi yang diinginkan, yang harus digabungkan dengan pewarna fluoresen. Prosedur inkubasi terdiri dari membuat pengenceran antibodi dalam larutan yang juga mengandung BSA tetapi dalam proporsi yang lebih rendah.
Jika kasusnya adalah imunofluoresensi sekunder atau tidak langsung, dua inkubasi berturut-turut harus dilakukan. Pertama dengan antibodi yang diinginkan dan kemudian dengan antibodi yang mampu mendeteksi daerah konstan dari imunoglobulin primer. Antibodi sekunder inilah yang secara kovalen terikat pada fluorofor.
Teknik ini sangat serbaguna, memungkinkan pelabelan simultan lebih dari satu antigen per sampel, selama ada antibodi primer digabungkan ke fluorofor yang berbeda, dalam kasus imunofluoresensi langsung.
Untuk pelabelan simultan dalam imunofluoresensi tidak langsung, perlu untuk memastikan bahwa setiap antibodi primer diproduksi pada hewan yang berbeda, serta bahwa setiap antibodi sekunder digabungkan ke fluorofor yang berbeda.
Seperti halnya pemblokiran, inkubasi dengan antibodi memberikan hasil yang lebih baik semakin lama waktu inkubasi. Setelah setiap langkah perlu untuk membersihkan kelebihan antibodi yang tidak mengikat sampel dan dalam imunofluoresensi sekunder perlu untuk memblokir sebelum menambahkan antibodi sekunder.
Teknik tertentu menggunakan pewarnaan lain yang tidak terkait dengan imunostaining, seperti pewarnaan DNA inti dengan fluorofor DAPI.
Perakitan dan observasi
Selama waktu inkubasi terakhir dengan fluorofor, sampel harus tetap berada dalam gelap. Untuk pengamatan di bawah mikroskop, biasanya menggunakan beberapa zat untuk mempertahankan fluoresensi fluorofor yang digabungkan dengan antibodi.
Jenis
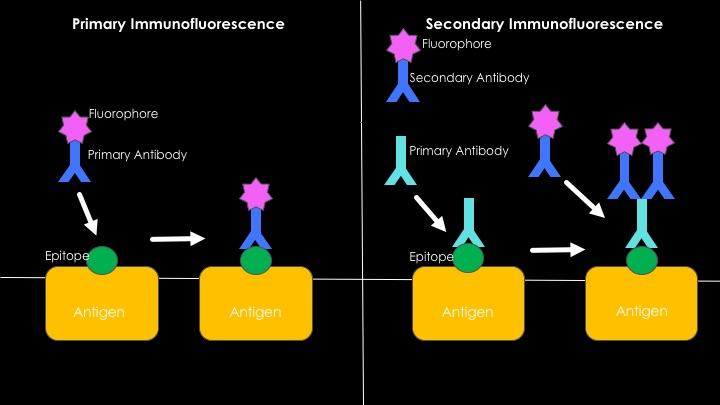
Ringkasan grafis imunofluoresensi langsung dan tidak langsung (Sumber: Westhayl618 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Imunofluoresensi langsung atau primer
Ini ada hubungannya dengan deteksi antigen melalui penggunaan antibodi fluoresen. Keuntungan utama menggunakan teknik ini adalah kecepatannya, namun, banyak kasus pengikatan nonspesifik dapat terjadi dalam prosesnya, terutama ketika mempelajari serum manusia, karena mereka kaya akan antibodi yang sangat heterogen.
Imunofluoresensi tidak langsung atau sekunder
Ini juga dikenal sebagai teknik “sandwich” dan ini melibatkan pengembangan teknik dalam dua langkah. Yang pertama berkaitan dengan penggunaan antibodi non-fluoresen dan ikatannya dengan antigen yang diinginkan.
Terhadap daerah konstan antibodi pertama ini (yang sekarang akan berfungsi sebagai antigen), antibodi kedua yang mampu mengenalinya digunakan, yang dikaitkan dengan molekul fluoresen.
Munculnya sinyal fluoresen akan menjadi hasil pengenalan spesifik antara antibodi non-fluoresen pertama dan antigen yang diinginkan; kehadiran antibodi pertama ini menentukan antibodi kedua, yang diberi label dan berkat itu ada atau tidaknya antigen dapat ditentukan.
Meskipun merupakan teknik yang jauh lebih memakan waktu daripada imunofluoresensi langsung (karena mencakup satu langkah inkubasi lagi), teknik ini tidak menyiratkan desain antibodi fluoresen untuk setiap antigen yang dipelajari, yang menghasilkan, dalam istilah ekonomi, lebih layak.
Selain itu, ini adalah teknik yang lebih sensitif dalam hal amplifikasi sinyal, karena lebih dari satu antibodi sekunder dapat mengikat ke wilayah konstan dari antibodi primer, sehingga memperkuat intensitas sinyal fluoresen.
Kegunaan
Seperti yang mungkin telah dicatat sebelumnya, imunofluoresensi adalah teknik yang sangat serbaguna, yang telah diberikan banyak kegunaan dalam bidang ilmiah dan klinis. Ini dapat digunakan untuk menjawab pertanyaan ekologi, genetik dan fisiologis mengenai banyak organisme.
Di antara aplikasi klinis, digunakan untuk diagnosis langsung beberapa penyakit dermatologis, baik menggunakan imunofluoresensi langsung atau tidak langsung pada jaringan epitel pasien yang diteliti.
Teknik imunofluoresensi telah tersedia dalam organisme bersel tunggal seperti ragi untuk memvisualisasikan mikrotubulus intranuklear dan sitoplasma, aktin dan protein terkait, filamen 10nm, dan konstituen lain dari sitoplasma , membran, dan dinding sel.
Referensi
- Abcam, Imunositokimia dan protokol imunofluoresensi. Diperoleh dari abcam.com
- Greph, C. (2012). Pewarna Fluoresens. Diperoleh dari leica-microsystems.com
- Miller, DM, & Shakest, DC (1995). Mikroskop imunofluoresensi. Dalam Metode dalam Biologi Sel (Vol. 48, hlm. 365–394). Pers Akademik, Inc.
- Odell, ID, & Cook, D. (2013). Teknik Imunofluoresensi. Jurnal Dermatologi Investigasi , 133 , 1-4.
- Princle, BJR, Adams, AEM, Druain, DG, & Brian, K. (1991). Metode imunofluoresensi untuk ragi. Dalam Metode Enzimologi (Vol. 194, hlm. 565–602). Pers Akademik, Inc.
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Kegunaan imunofluoresensi dalam Virologi Kesehatan Masyarakat. Ulasan Bakteriologis , 28 (4), 402–408.
- Vrieling, EG, & Anderson, DM (1996). Imunofluoresensi dalam penelitian fitoplankton: aplikasi dan potensi. J: Fikol. , 32 , 1–16.

