hidrolase adalah enzim-enzim yang bertanggung jawab untuk hidrolisis berbagai jenis ikatan kimia di banyak senyawa yang berbeda. Di antara ikatan utama yang terhidrolisis adalah ikatan ester, glikosidik, dan peptida.
Dalam kelompok hidrolase, lebih dari 200 enzim yang berbeda telah diklasifikasikan, dikelompokkan menjadi setidaknya 13 set individu; klasifikasi mereka pada dasarnya didasarkan pada jenis senyawa kimia yang berfungsi sebagai substrat mereka.
![Pecaralan grafis dengan alat bioinformatika dari struktur hidrolase (Sumber: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik] Via Wikimedia Commons)](https://cdn2.sridianti.com/apa-itu/wp-content/uploads/2021/12/PDB_1ezr_EBI.jpg)
Pecaralan grafis dengan alat bioinformatika dari struktur hidrolase (Sumber: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik] Via Wikimedia Commons)
Hidrolase sangat penting untuk pencernaan makanan di usus hewan, karena mereka bertanggung jawab untuk menurunkan sebagian besar ikatan yang membentuk struktur karbon dari makanan yang mereka makan.
Enzim-enzim ini bekerja di media berair, karena mereka membutuhkan molekul air di sekitarnya untuk ditambahkan ke senyawa setelah molekul dipecah. Dengan kata sederhana, hidrolase melakukan katalisis hidrolitik senyawa di mana mereka bertindak.
Misalnya, ketika hidrolase memutuskan ikatan kovalen CC, hasilnya biasanya gugus C-OH dan gugus CH.
Indeks artikel
Struktur
Seperti banyak enzim, hidrolase adalah protein globular yang disusun menjadi struktur kompleks yang mengatur diri mereka sendiri melalui interaksi intramolekul.
Hidrolase, seperti semua enzim, mengikat satu atau lebih molekul substrat di wilayah strukturnya yang dikenal sebagai “situs aktif”. Situs ini adalah kantong atau celah yang dikelilingi oleh banyak residu asam amino yang memfasilitasi cengkeraman atau perlekatan substrat.
Setiap jenis hidrolase spesifik untuk substrat tertentu, yang ditentukan oleh struktur tersiernya dan oleh konformasi asam amino yang membentuk situs aktifnya. Kekhususan ini diangkat secara didaktik oleh Emil Fischer sebagai semacam “gembok dan kunci”.
Sekarang diketahui bahwa substrat umumnya menginduksi perubahan atau distorsi dalam konformasi enzim dan bahwa enzim, pada gilirannya, mendistorsi struktur substrat untuk membuatnya “cocok” ke situs aktifnya.
Fitur
Semua hidrolase memiliki fungsi utama untuk memutuskan ikatan kimia antara dua senyawa atau dalam struktur molekul yang sama.
Ada hidrolase untuk memutuskan hampir semua jenis ikatan: beberapa menurunkan ikatan ester antara karbohidrat, yang lain ikatan peptida antara asam amino protein, yang lain ikatan karboksilat, dll.
Tujuan hidrolisis ikatan kimia yang dikatalisis oleh enzim hidrolase sangat bervariasi. Lisozim, misalnya, bertanggung jawab untuk hidrolisis ikatan kimia dengan tujuan melindungi organisme yang mensintesisnya.
Enzim ini memecah ikatan yang menyatukan senyawa di dinding sel bakteri, untuk melindungi tubuh manusia dari proliferasi bakteri dan kemungkinan infeksi.
Nuklease adalah enzim “fosfatase” yang memiliki kemampuan untuk mendegradasi asam nukleat, yang juga dapat mewakili mekanisme pertahanan seluler terhadap virus DNA atau RNA .
Hidrolase lain, seperti jenis “protease serin”, mendegradasi ikatan peptida protein dalam saluran pencernaan untuk membuat asam amino berasimilasi di epitel gastrointestinal.
Hidrolase bahkan terlibat dalam berbagai peristiwa produksi energi dalam metabolisme sel, karena fosfatase mengkatalisis pelepasan molekul fosfat dari substrat berenergi tinggi seperti piruvat, dalam glikolisis.
Contoh Hidrolase
Di antara keragaman besar hidrolase yang telah diidentifikasi para ilmuwan, beberapa telah dipelajari dengan penekanan lebih besar daripada yang lain, karena mereka terlibat dalam banyak proses penting untuk kehidupan seluler.
Ini termasuk lisozim, protease serin, fosfatase tipe endonuklease, dan glukosidase atau glikosilase.
Lisozim
Enzim jenis ini memecah lapisan peptidoglikan dinding sel bakteri gram positif. Ini biasanya berakhir menyebabkan lisis total bakteri.
Lisozim melindungi tubuh hewan dari infeksi bakteri dan berlimpah dalam sekresi tubuh di jaringan yang bersentuhan dengan lingkungan, seperti air mata, air liur, dan lendir.
Lisozim telur ayam adalah struktur protein pertama yang dikristalkan melalui sinar-X. Kristalisasi ini dilakukan oleh David Phillips, pada tahun 1965, di Royal Institute di London.
Situs aktif enzim ini terdiri dari peptida Asparagine-Alanine-Methionine-Asparagine-Alanine-Glycine-Asparagine-Alanine-Methionine (NAM-NAG-NAM).
protease serin
Enzim dari kelompok ini bertanggung jawab untuk menghidrolisis ikatan peptida dalam peptida dan protein. Yang paling umum dipelajari adalah tripsin dan kimotripsin; namun, ada banyak jenis protease serin yang berbeda, yang bervariasi sehubungan dengan spesifisitas substrat dan mekanisme katalisisnya.
“serin protease” dicirikan dengan memiliki asam amino nukleofilik jenis serin di situs aktifnya, yang berfungsi dalam pemecahan ikatan peptida antara asam amino. Protease serin juga mampu memutuskan berbagai macam ikatan ester.
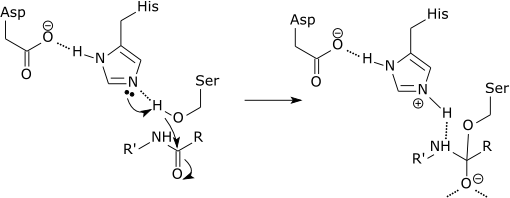
Skema grafis aksi protease serin yang memutus ikatan peptida dalam asam amino histidin (Sumber: Zephyris di Wikipedia bahasa Inggris [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/ ) ] Melalui Wikimedia Commons)
Enzim-enzim ini memotong peptida dan protein secara tidak spesifik. Namun, semua peptida dan protein yang akan dipotong harus melekat pada N-terminus ikatan peptida ke situs aktif enzim.
Setiap protease serin secara tepat memotong ikatan amida yang terbentuk antara ujung terminal-C asam amino pada ujung karboksil dan asam amino amina yang menuju ujung terminal-N peptida.
Fosfatase tipe nuklease
Enzim-enzim ini mengkatalisis pemutusan ikatan fosfodiester gula dan fosfat basa nitrogen yang membentuk nukleotida. Ada banyak jenis enzim ini, karena mereka khusus untuk jenis asam nukleat dan situs pembelahan.

Skema grafis aksi endonuklease yang menghidrolisis ikatan fosfodiester (Sumber: J3D3 [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] Melalui Wikimedia Commons)
Endonuklease sangat diperlukan dalam bidang bioteknologi, karena memungkinkan para ilmuwan untuk memodifikasi genom organisme dengan memotong dan mengganti fragmen informasi genetik dari hampir semua sel.
Endonuklease memotong basa nitrogen dalam tiga langkah. Yang pertama adalah melalui asam amino nukleofilik, kemudian terbentuk struktur perantara dengan muatan negatif yang menarik gugus fosfat dan akhirnya memutuskan ikatan antara kedua basa.
Referensi
- Davies, G., & Henrissat, B. (1995). Struktur dan mekanisme glikosil hidrolase. Struktur, 3 (9), 853-859.
- Lehninger, AL, Nelson, DL, Cox, MM, & Cox, MM (2005). Prinsip biokimia Lehninger. Macmillan.
- Mathews, AP (1936). Prinsip-prinsip biokimia. W. Kayu.
- Murray, RK, Granner, DK, Mayes, P., & Rodwell, V. (2009). Biokimia Harper yang diilustrasikan. 28 (hal. 588). New York: McGraw-Hill.
- Ollis, DL, Cheah, E., Cygler, M., Dijkstra, B., Frolow, F., Franken, SM,… & Sussman, JL (1992). Lipatan / hidrolase. Rekayasa Protein, Desain dan Seleksi, 5 (3), 197-211.

