Anafilatoksin adalah fragmen peptida penerbangan berat molekul yang dihasilkan oleh aktivasi sistem komplemen. Mereka sangat hidrofilik, dengan struktur alfa heliks dihubungkan oleh 3 jembatan disulfida.
Mereka diaktifkan secara proteolitik oleh pembelahan di situs tertentu, membentuk fragmen a dan b. Peptida ini mengikat reseptor spesifik yang diekspresikan pada permukaan sel dan memperkuat berbagai reaksi inflamasi, bertindak sebagai aktivator sel.
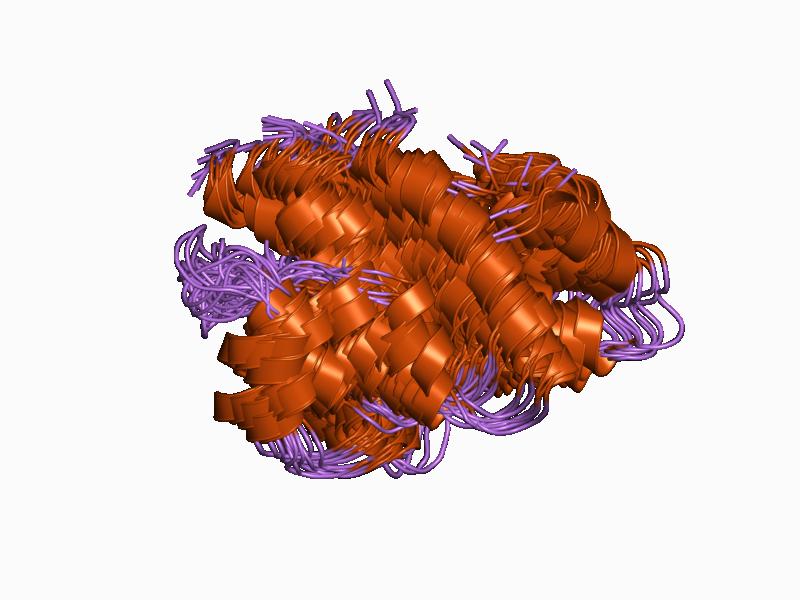
Protein C5a tipe anafilotoksin. Oleh Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik (https://creativecommons.org/licenses)], dari Wikimedia Commons.
Fungsi efektornya meliputi kemotaksis, pelepasan mediator inflamasi, dan aktivasi granulosit, sel mast, dan makrofag. Baru-baru ini juga telah ditunjukkan bahwa anafilatoksin dihasilkan secara lokal di dalam jaringan dengan adanya patogen.
Indeks artikel
Jenis
Anaphyllotoxins termasuk peptida C3a, C5a, dan C4a. Ini adalah fragmen pembelahan massa molekul rendah (~ 10 kDa) dari rantai komponen komplemen C3, C4, dan C5, masing-masing, yang dilepaskan selama aktivasi komplemen.
Namun, perlu dicatat bahwa untuk C4a, hanya ditunjukkan bahwa ia mengikat reseptornya dengan afinitas rendah dan tidak ada reseptor spesifik untuknya yang telah diidentifikasi.
Untuk bagiannya, C5a adalah yang paling kuat dari peptida ini, yaitu, ia mempromosikan peradangan dan merupakan penarik kemo yang kuat untuk neutrofil, makrofag dan monosit.
Meskipun vertebrata yang lebih rendah memiliki sistem komplemen yang diyakini berfungsi serupa dengan mamalia, reseptor anafilatoksin sebelumnya belum pernah dikarakterisasi pada vertebrata non-mamalia.
Fitur
Anaphyllotoxins dihasilkan dari pembelahan enzimatik selama aktivasi komplemen melalui jalur klasik, lektin, atau alternatif.
Dalam kaskade aktivasi komplemen, pembelahan C3 atau C5 oleh konvertase C3 atau C5 mengarah pada pembentukan fragmen besar, C3b atau C5b, dan fragmen peptida kecil, C3a atau C5a.
C3b dan C5b melanjutkan kaskade aktivasi komplemen pada permukaan mikroba atau sel, sementara C3a dan C5a dilepaskan dalam fase cair untuk bertindak sebagai anafilatoksin, yang memediasi berbagai tindakan biologis.
Mereka meningkatkan permeabilitas pembuluh darah, merangsang kontraksi otot polos dan menginduksi pelepasan histamin dari sel mast dan butiran sekretori dari granulosit dan makrofag.
Selain itu, C5a, salah satu peptida yang paling poten, merupakan chemoattractant yang kuat untuk neutrofil dan leukosit lainnya.
Sifat kemoatraktan belum dikaitkan dengan C4a, sedangkan C3a tampaknya menargetkan terutama eosinofil, sel mast, dan sel induk hemopoietik, kontraksi otot polos, peningkatan permeabilitas kapiler darah, dan bahkan syok anafilaksis.
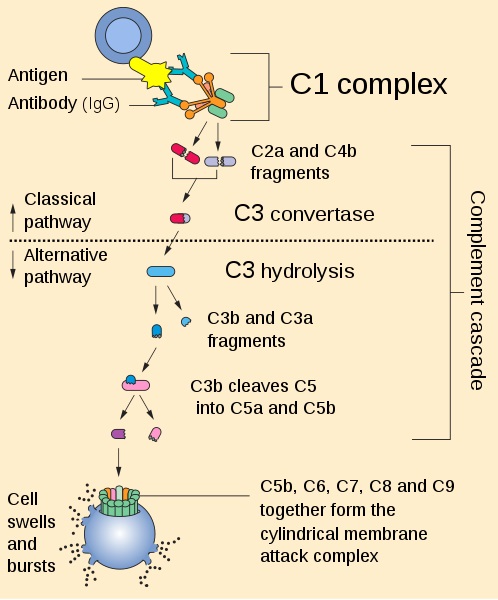
Ringkasan jalur aktivasi kaskade komplemen. Oleh Perhelion [Domain publik (https://creativecommons.org/licenses)], dari Wikimedia Commons. .
Asosiasi C5a dan C3a dengan patogenesis
Meskipun inflamasi yang dimediasi oleh C5a dan C3a memainkan peran penting dalam pengendalian infeksi, sejumlah studi klinis telah menunjukkan bahwa mereka juga terkait dengan patogenesis berbagai penyakit inflamasi dan autoimun seperti sepsis, lupus eritematosus sistemik (SLE), keguguran, sindrom antibodi antifosfolipid (APS), iskemia dan asma.
Dengan demikian, telah disarankan bahwa menyerang reseptor dan / atau ligan C5a dan C3a dapat mengurangi respons inflamasi yang tidak diinginkan, serta kerusakan jaringan dalam kondisi patologis tertentu. C5a dan C3a dapat menjadi target terapi yang efisien.
Penerima
Secara umum, anafilatoksin mengerahkan sebagian besar aktivitas biologis melalui pengikatan tiga reseptor terkait, yaitu; reseptor C3a, reseptor C5a dan reseptor mirip C5a, C5L2.
Pada manusia, tiga jenis reseptor transmembran telah diidentifikasi yang memediasi aksi anafilatoksin: C3aR, yang secara spesifik berikatan dengan C3a; C5aR, yang mengikat C5a; dan C5L2, di mana ketiga anafilatoksin dapat menjadi ligan.
Dua reseptor pertama mengikat protein G regulator, sedangkan reseptor C5L2 telah terbukti tidak sesuai dengan jalur pensinyalan yang dimediasi protein G.
Distribusi reseptor ini tidak terbatas pada leukosit. Mereka juga diekspresikan dalam banyak jenis sel non-myeloid, termasuk hepatosit, sel epitel paru, sel endotel, astrosit otak, dan sel mikroglia.
Pada tipe sel ini, mereka dapat memediasi partisipasi anafilatoksin dalam berbagai kondisi neurologis vaskular, paru, regeneratif, dan degeneratif.
Jika anafilatoksin tidak berikatan dengan reseptornya, mereka dengan cepat dicerna oleh karboksipeptidase plasma, yang menghilangkan residu arginin terminal-C dari setiap peptida.
Turunan arginin tidak aktif atau memiliki aktivitas 10 sampai 1000 kali lebih rendah dari peptida asli.
Sistem komplemen pada vertebrata yang lebih rendah
Vertebrata yang lebih rendah, seperti reptil, amfibi, dan ikan, memiliki sistem pelengkap yang, dalam banyak hal, dianggap secara fungsional mirip dengan mamalia.
Respon imun protektif yang dimediasi oleh komplemen, seperti sitolisis dan opsonisasi, telah ditunjukkan pada beberapa hewan ini.
Baru-baru ini, telah ditunjukkan bahwa C3a dari tunicate Ciona intestinalis memiliki aktivitas kemotaktik untuk hemosit tunicate, menunjukkan adanya reseptor C3aR pada hewan-hewan ini.
Protochordate, pada bagian mereka, mungkin tidak memiliki C4a dan C5a, sehingga diyakini bahwa jalur aktivasi komplemen klasik, yang menghasilkan C4a, dan jalur litik, yang menghasilkan C5a, tidak ada pada hewan ini.
Namun, ikan gnathostomous memiliki semua jalur aktivasi komplemen yang diketahui, dan molekul C3, C4, dan C5 telah diidentifikasi dari beberapa spesies ikan. Menariknya, ikan memiliki beberapa isoform dari beberapa komponen pelengkap, termasuk C3, C2/Bf, C4, dan C5.
Meskipun fungsi yang berbeda telah disarankan untuk isoform C3, masih harus ditetapkan apakah ada reseptor yang berbeda untuk isoform ini.
Referensi
- Dari Yang. Anafilatoksin. Handbook of Biologically Active Peptides.pp.625-630 http://dx.doi.org/10.1016/B978-0-12-385095-9.00085-3
- Gennaro R, Simonic T, Negri A, Mottola C, Secchi C, Ronchi S, Romeo D. C5a fragmen pelengkap sapi. Pemurnian, bioassay, urutan asam amino dan studi struktural lainnya. Jurnal Biokimia Eropa. 1986; 155 (1): 77-86.
- Holland CH, Lambris JD. Reseptor Anaphylatoxin C5a Fungsional dalam Spesies Teleost. Jurnal Imunologi. 2004; 172 (1): 349-355.
- Klos A, Tenner AJ, Johswich K, Ager R, Reis ES, Köhlc J. Peran Anaphylatoxins dalam Kesehatan dan Penyakit. Imunologi molekuler. 2009; 46 (14): 2753-2766.
- Ogata RT, Rosa PA, Zepf NE. Urutan gen untuk komponen pelengkap murine C4. Jurnal Kimia Biologi. 1989, 264 (28): 16565-16572.
- Peng Q, Li K, Sacks SH, Zhou W. Peran anaphylatoxins C3a dan C5a dalam mengatur respon imun bawaan dan adaptif. Target Obat Peradangan & Alergi. 2009; 8 (3): 236-246.

