fenilalanin (Phe, F) adalah salah satu dari sembilan asam amino esensial, yaitu tidak disintesis secara endogen oleh tubuh manusia. Pada rantai sampingnya, asam amino ini memiliki senyawa aromatik non-polar yang menjadi ciri khasnya.
Fenilalanin, atau asam -fenil-α-amino propionat, pertama kali diidentifikasi pada tahun 1879 oleh ilmuwan JH Schulze dan M. Barbieri dari tanaman keluarga Fabaceae yang dikenal sebagai Lupinus luteus atau “lupin kuning”.
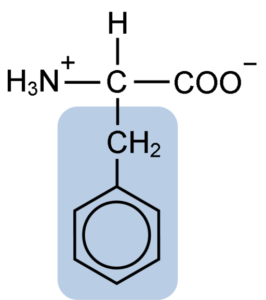
Struktur kimia asam amino Fenilalanin (Sumber: Clavecin [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Dipeptide L-phenylalanine-L-aspartyl dikenal sebagai aspartam atau “NutraSweet”, yang merupakan pemanis yang diproduksi secara sintetis dan banyak digunakan di restoran dan kafe, biasanya untuk mempermanis minuman seperti kopi, teh, limun dan minuman lainnya.
Pada buah-buahan dengan karakteristik klimakterik, konversi L-fenilalanin menjadi ester fenolik seperti eugenol dan turunan metilnya inilah yang menimbulkan aroma bunga manis atau seperti madu khas buah pisang dan pisang raja saat matang.
Tergantung pada bentuknya, fenilalanin dapat memiliki rasa yang berbeda. Misalnya, bentuk L-fenilalanin memiliki aroma dan rasa yang manis, sedangkan bentuk D-fenilalanin sedikit pahit dan biasanya tidak berbau.
Karena memiliki karakter hidrofobik yang kuat, fenilalanin adalah salah satu konstituen utama dari banyak resin di alam, seperti polistirena. Resin ini, ketika bersentuhan dengan molekul air, membentuk struktur pelindung atau penutup yang dikenal sebagai “klatrat”.
Gen yang mengkode jalur biosintesis fenilalanin digunakan oleh ahli botani sebagai jam evolusi, karena gen tersebut telah ditemukan terkait dengan diversifikasi morfologi tanaman terestrial.
Indeks artikel
Karakteristik dan struktur
Fenilalanin berbagi dengan semua asam amino gugus karboksil (-COOH), gugus amino (-NH2), dan atom hidrogen (-H) yang terikat pada atom karbon pusat yang dikenal sebagai -karbon. Selain itu, tentu saja, ia memiliki gugus R atau rantai samping yang khas.
Fenilalanin adalah salah satu dari tiga asam amino yang memiliki cincin aromatik atau benzena sebagai substituen pada rantai samping. Senyawa ini nonpolar dan karena itu sangat hidrofobik.
Asam amino yang dimaksud terutama bersifat hidrofobik, karena, tidak seperti tirosin dan triptofan (dua asam amino lainnya dengan cincin aromatik) asam amino tidak memiliki gugus amino atau hidroksil yang terikat pada cincin benzenanya.
Gugus aromatik, benzoat atau arena dari fenilalanin memiliki struktur khas benzena: cincin siklik disusun oleh 6 atom karbon yang memiliki resonansi satu sama lain karena adanya tiga ikatan rangkap dan tiga ikatan tunggal di dalamnya.
Tidak seperti tirosin dan triptofan, yang pada pH basa masing-masing dapat memperoleh muatan positif dan negatif, fenilalanin mempertahankan muatan netralnya, karena cincin benzena tidak terionisasi dan muatan pada gugus karboksil dan amino saling menetralkan.
Klasifikasi
Asam amino diklasifikasikan ke dalam kelompok yang berbeda sesuai dengan karakteristik yang dimiliki rantai samping atau gugus R, karena ini dapat bervariasi dalam ukuran, struktur, gugus fungsi, dan bahkan dalam muatan listrik.
Seperti disebutkan, fenilalanin diklasifikasikan dalam kelompok asam amino aromatik, bersama dengan tirosin dan triptofan. Semua senyawa ini memiliki cincin aromatik dalam strukturnya, namun tirosin dan triptofan memiliki gugus yang dapat terionisasi dalam substituen gugus R mereka.
Sifat penyerapan cahaya protein pada panjang gelombang 280 nm disebabkan oleh adanya asam amino yang diklasifikasikan dalam kelompok fenilalanin, karena mereka dengan mudah menyerap sinar ultraviolet melalui cincin aromatiknya.
Namun, telah ditunjukkan bahwa fenilalanin menyerap jauh lebih sedikit daripada tirosin dan triptofan, sehingga dalam analisis beberapa protein absorbansinya dapat diprediksi.
Stereokimia
Semua asam amino memiliki karbon pusat kiral, yang memiliki empat atom atau gugus berbeda yang terikat dan, seperti telah disebutkan, atom ini diidentifikasi sebagai karbon-. Berdasarkan karbon ini, setidaknya dua stereoisomer dari setiap asam amino dapat ditemukan.
Stereoisomer adalah molekul bayangan cermin, yang memiliki rumus molekul yang sama, tetapi tidak saling tumpang tindih, seperti tangan dan kaki. Senyawa yang secara eksperimental memutar bidang cahaya terpolarisasi ke kanan dilambangkan dengan huruf D, dan senyawa yang berputar ke kiri dengan huruf L.
Penting untuk dikomentari bahwa perbedaan antara bentuk D-fenilalanin dan L-fenilalanin adalah kunci untuk memahami metabolisme asam amino ini dalam tubuh vertebrata .
Bentuk L-fenilalanin dimetabolisme dan digunakan untuk pembangunan protein seluler, sedangkan D-fenilalanin telah ditemukan dalam aliran darah sebagai agen pelindung terhadap spesies oksigen reaktif (ROS).
Fitur
Pada tahun 1990-an diperkirakan fenilalanin hanya ditemukan pada beberapa jenis tumbuhan. Namun, hari ini diketahui hadir di hampir semua domain hidrofobik protein, pada kenyataannya, fenilalanin adalah komponen utama spesies kimia aromatik protein.
Pada tumbuhan, fenilalanin merupakan komponen penting dari semua protein; Selain itu, ini adalah salah satu prekursor metabolit sekunder seperti fenilpropanoid (yang merupakan bagian dari pigmen) molekul pertahanan, flavonoid, biopolimer seperti lignin dan suberin, antara lain.
Fenilalanin adalah struktur dasar untuk banyak molekul yang mempertahankan homeostasis neuron, termasuk peptida seperti vasopresin, melanotropin, dan enkephalin. Selanjutnya, asam amino ini terlibat langsung dalam sintesis hormon adrenokortikotropik (ACTH).
Seperti sebagian besar asam amino protein, fenilalanin adalah bagian dari kelompok asam amino ketogenik dan glukogenik, karena menyediakan kerangka karbon intermediet siklus Krebs, yang diperlukan untuk metabolisme energi seluler dan tubuh.
Bila berlebihan, fenilalanin diubah menjadi tirosin dan kemudian menjadi fumarat, zat antara dari siklus Krebs.
Biosintesis
Fenilalanin adalah salah satu dari sedikit asam amino yang tidak dapat disintesis oleh sebagian besar organisme vertebrata. Saat ini, hanya jalur biosintetik untuk asam amino ini yang diketahui pada organisme prokariotik, pada ragi, pada tumbuhan dan pada beberapa spesies jamur.
Gen yang bertanggung jawab untuk jalur sintesis sangat terkonservasi antara tanaman dan mikroorganisme, oleh karena itu, biosintesis memiliki langkah serupa di hampir semua spesies. Bahkan beberapa enzim dari jalur tersebut ada pada beberapa hewan, namun mereka tidak dapat mensintesisnya.
Biosintesis fenilalanin pada tumbuhan
Pada spesies tumbuhan, fenilalanin disintesis melalui jalur metabolisme internal dalam kloroplas yang dikenal sebagai “jalur prefenat”. Jalur ini secara metabolik terkait dengan “jalur shikimate”, melalui L-arogenat, salah satu metabolit yang dihasilkan selama yang terakhir.
Enzim arogenat dehidratase mengkatalisis reaksi tiga langkah, di mana ia mengubah cincin aromatik arogenat menjadi cincin benzena karakteristik fenilalanin.
Enzim ini mengkatalisis transaminasi, dehidrasi dan dekarboksilasi untuk memurnikan cincin aromatik arogenat dan mendapatkan cincin tanpa substituen.
Prefenat, bersama dengan fenilpiruvat yang terakumulasi di dalam (cahaya) kloroplas, dapat diubah menjadi fenilalanin melalui reaksi yang dikatalisis oleh enzim profenat aminotransferase, yang mentransfer gugus amino ke fenilpiruvat sehingga dikenali oleh arogenat dehidratase dan dimasukkan ke dalam sintesis fenilalanin.
Dalam beberapa spesies Pseudomonas rute alternatif ke prophenate telah dijelaskan, yang menggunakan enzim yang berbeda tetapi substrat untuk sintesis fenilalanin juga prefenat dan arogenat.
Degradasi
Fenilalanin dapat dimetabolisme dalam berbagai cara dari makanan. Namun, sebagian besar penelitian berfokus pada nasib mereka di sel-sel jaringan saraf pusat dan jaringan ginjal.
Hati adalah organ utama untuk pemecahan atau katabolisme fenilalanin. Di dalam hepatosit terdapat enzim yang dikenal sebagai fenilalanin hidroksilase, yang mampu mengubah fenilalanin menjadi tirosin atau senyawa L-3,4-dihidroksifenilalanin (L-DOPA).
Senyawa L-DOPA adalah prekursor norepinefrin, epinefrin, dan hormon serta peptida lainnya dengan aktivitas di sistem saraf .
Fenilalanin dapat dioksidasi dalam sel otak oleh enzim tirosin hidroksilase, yang bertanggung jawab untuk mengkatalisis konversi fenilalanin menjadi dopakrom dengan adanya asam L-askorbat.
Sebelumnya diperkirakan bahwa enzim tirosin hidroksilase hanya menghidroksilasi tirosin, namun ditemukan bahwa ini menghidroksilat fenilalanin dan tirosin dalam rasio yang sama dan bahwa hidroksilasi fenilalanin menghambat hidroksilasi tirosin.
Kadar tirosin yang tinggi sekarang diketahui menghambat aktivitas enzimatik tirosin hidroksilase, tetapi hal yang sama tidak berlaku untuk fenilalanin.
Makanan kaya fenilalanin
Semua makanan kaya protein memiliki kandungan fenilalanin antara 400 dan 700 mg per porsi makanan yang dimakan. Makanan seperti minyak ikan cod, tuna segar, lobster, tiram, dan bivalvia lainnya mengandung lebih dari 1.000 mg per porsi makanan yang dimakan.
Daging sapi dan babi juga memiliki kadar fenilalanin yang tinggi. Namun, mereka tidak setinggi konsentrasi yang ada pada hewan laut. Misalnya, bacon, daging sapi, hati, ayam, dan produk susu memiliki 700-900 mg fenilalanin per porsi makanan.
Kacang-kacangan seperti kacang tanah dan kenari dari berbagai jenis adalah makanan lain yang memiliki jumlah fenilalanin yang baik. Biji-bijian seperti kedelai, buncis, dan kacang-kacangan lainnya dapat menyediakan antara 500 dan 700 mg fenilalanin per porsi.
Sebagai sumber alternatif, fenilalanin dapat dimetabolisme dari aspartam dalam minuman ringan, permen karet, jeli dan beberapa permen atau makanan penutup di mana dipeptida ini digunakan sebagai pemanis.
Manfaat asupannya
Fenilalanin ditemukan di semua makanan kaya protein yang kita makan. Konsumsi harian minimum untuk orang dewasa dengan berat dan tinggi rata – rata adalah sekitar 1000 mg, yang diperlukan untuk sintesis protein, hormon seperti dopamin , berbagai neurotransmiter, dll.
Konsumsi asam amino ini secara berlebihan diresepkan untuk orang dengan gangguan depresi, nyeri sendi dan penyakit kulit, karena konsumsinya meningkatkan sintesis protein dan biomolekul pemancar seperti epinefrin, norepinefrin, dan dopamin.
Beberapa penelitian menunjukkan bahwa fenilalanin yang dikonsumsi secara berlebihan tidak menghasilkan perbaikan yang signifikan pada gangguan ini, tetapi konversinya menjadi tirosin, yang juga digunakan untuk sintesis molekul pensinyalan, dapat menjelaskan efek positif pada pensinyalan sel dalam sistem saraf.
Obat yang diformulasikan untuk mengatasi konstipasi memiliki inti yang tersusun oleh fenilalanin, tirosin, dan triptofan. Obat-obat ini umumnya mengandung campuran ketiga asam amino ini dalam bentuk L- dan D-nya.
Gangguan kekurangan
Tingkat fenilalanin dalam darah penting untuk mempertahankan fungsi otak yang tepat, karena fenilalanin, tirosin, dan triptofan adalah substrat untuk perakitan berbagai neurotransmiter.
Sebaliknya, beberapa gangguan terkait dengan defisit dalam metabolisme asam amino ini, yang menghasilkan kelebihannya, daripada kekurangannya.
Fenilketonuria, penyakit bawaan yang jarang pada wanita, mempengaruhi hidroksilasi hepatik dari fenilalanin dan menyebabkan kadar asam amino ini dalam plasma berlebihan, menginduksi apoptosis neuron dan mempengaruhi perkembangan otak normal.
Jika seorang wanita dengan fenilketonuria menjadi hamil, janin dapat mengembangkan apa yang dikenal sebagai “sindrom hiperfenilalaninemia ibu janin.”
Hal ini disebabkan oleh fakta bahwa janin memiliki konsentrasi fenilalanin yang tinggi dalam darah (hampir dua kali lipat standar), yang asalnya terkait dengan tidak adanya fenilalanin hidroksilase hati pada janin, yang tidak berkembang sampai usia kehamilan 26 minggu .
Sindrom janin akibat hiperfenilalaninemia ibu menghasilkan mikrosefali janin, keguguran berulang, penyakit jantung, dan bahkan malformasi ginjal.
Referensi
- Biondi, R., Brancorsini, S., Poli, G., Egidi, MG, Capodicasa, E., Bottiglieri, L.,… & Micu, R. (2018). Deteksi dan pemulungan radikal hidroksil melalui hidroksilasi D-fenilalanin dalam cairan manusia. Talanta, 181, 172-181
- Cho, MH, Corea, OR, Yang, H., Bedgar, DL, Laskar, DD, Anterola, AM,… & Kang, C. (2007). Biosintesis fenilalanin dalam identifikasi dan karakterisasi Arabidopsis thaliana Arogenat dehidratases. Jurnal Kimia Biologi, 282 (42), 30827-30835.
- Fernstrom, JD, & Fernstrom, MH (2007). Sintesis dan fungsi tirosin, fenilalanin, dan katekolamin di otak. Jurnal Nutrisi, 137 (6), 1539S-1547S.
- Hou, J., Vázquez-González, M., Fadeev, M., Liu, X., Lavi, R., & Willner, I. (2018). Oksidasi Dikatalis dan Elektrokatalis dari l-Tirosin dan l-Phenilalanin menjadi Dopachrome oleh Nanozymes. Huruf nano, 18 (6), 4015-4022.
- Nelson, DL, Lehninger, AL, & Cox, MM (2008). Prinsip Biokimia Lehninger. Macmillan.
- Perkins, R., & Vaida, V. (2017). Fenilalanin meningkatkan permeabilitas membran. Jurnal American Chemical Society, 139 (41), 14388-14391.
- Plimmer, RHA (1912). Konstitusi Kimia Protein (Vol. 1). Longman, Hijau.
- Tinsley, G. (2018). Jalur Kesehatan. Diakses pada 5 September 2018, dari www.healthline.com/nutrition/phenylalanine
- Tohge, T., Watanabe, M., Hoefgen, R., & Fernie, AR (2013). Biosintesis shikimate dan fenilalanin dalam garis keturunan hijau. Perbatasan dalam Ilmu Tanaman, 4, 62.

