pepsinogen adalah zymogen dari pepsin, enzim hidrolitik utama yang bertanggung jawab untuk melaksanakan pencernaan protein dalam lambung mamalia. Zymogen atau proenzim adalah prekursor enzim yang tidak aktif, yaitu mereka tidak mampu mengkatalisis reaksi yang dilakukan oleh bentuk aktifnya.
Aktivasinya tergantung pada perubahan struktur tiga dimensi protein yang menimbulkan pembentukan situs aktif fungsional. Perubahan ini, dalam banyak kasus, bertepatan dengan pemecahan proteolitik dari segmen protein.
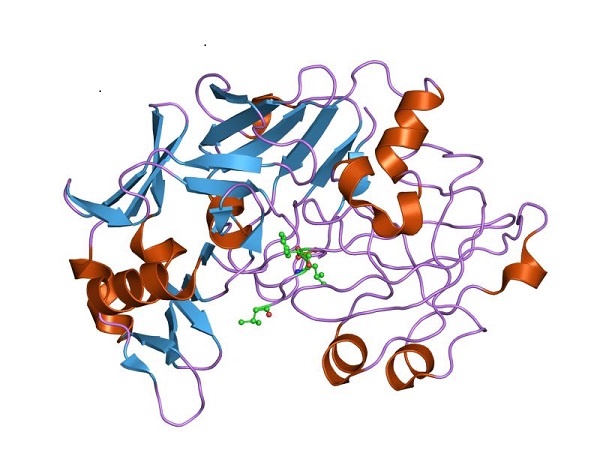
Struktur tiga dimensi pepsin, bentuk pepsinogen yang aktif secara katalitik. Oleh Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik (https://creativecommons.org/licenses/by-sa/4.0)], dari Wikimedia Commons
Oleh karena itu, pepsinogen harus mengalami perubahan struktural untuk memperoleh aktivitas peptidase yang diperlukan dan meningkatkan pencernaan protein di lambung, setelah asupan makanan.
Indeks artikel
Struktur
Pepsinogen adalah protein asam amino 371 milik keluarga besar proteinase aspartat, ditandai dengan memiliki residu asam aspartat di pusat aktifnya.
Struktur kuaternernya ditentukan untuk pertama kalinya untuk protein yang diekspresikan pada babi menggunakan teknik kristalografi sinar-X. Hasilnya serupa dengan yang ditunjukkan oleh bentuk protein yang matang atau aktif, pepsin.
Jadi, satu-satunya perbedaan yang ditemukan adalah adanya pepsinogen dari suatu peptida dari 44 asam amino yang terlipat di atas celah situs aktif. Pada posisi ini, menghambat interaksi protease ini dengan protein yang akan didegradasi.
Peptida ini, yang akan dibelah untuk menghasilkan enzim aktif, terletak di ujung terminal amino protein.
Karena hanya berfungsi sebagai sumbat, ketidakmampuan pepsinogen untuk mendegradasi protein bukan karena deformasi struktural pusat aktif. Sebaliknya, ia tetap dengan konformasi yang sama di kedua bentuk enzim.
Dalam pengertian ini, perlu dicatat bahwa struktur kristal pepsinogen merupakan caral perkiraan struktur zimogen lain yang termasuk dalam keluarga besar proteinase aspartat.
Fitur
Di awal kehidupan, pepsin (bentuk aktif pepsinogen) penting untuk pencernaan susu. Selanjutnya, fungsinya adalah untuk memecah protein makanan menjadi konstituennya (asam amino) untuk memudahkan penyerapannya.
Sintesis dan sekresi
Pepsinogen disintesis oleh sel utama dan sel fundus mukosa lambung. Selanjutnya, disimpan dalam vesikel sekretori yang tetap berada di sitoplasma sel-sel ini sampai pelepasannya diperlukan.
Oleh karena itu, sekresi zimogen ini merupakan proses yang diatur. Pelepasannya dari vesikel, menetap di sitosol melalui eksositosis, membutuhkan rangsangan hormonal dan saraf. Peningkatan kadar enzim lambung sekretin dan gastrin, serta asetilkolin, kolesistokinin, faktor pertumbuhan epidermal, dan oksida nitrat merangsang sintesis dan sekresi mereka.
Selain itu, percobaan yang dilakukan dengan sel AtT20, garis sel yang biasa digunakan dalam studi jalur sekresi pada mamalia, telah menunjukkan bahwa peningkatan AMP siklik juga mampu menginduksi sekresi tersebut.
Selain sekresi normalnya di lambung, jumlah pepsinogen yang relatif rendah telah terdeteksi baik dalam darah maupun urin, itulah sebabnya ia disebut uropepsinogen.
Asal usul uropepsinogen, serta perannya di kedua lokasi, masih belum ditentukan. Namun, ketidakhadirannya pada pasien yang perutnya telah diangkat seluruhnya tampaknya menunjukkan bahwa asalnya juga sakit perut.
Jenis
Dua jenis utama pepsinogen telah dijelaskan sejauh ini: pepsinogen I dan pepsinogen II. Kedua jenis tidak menunjukkan perbedaan dalam aktivitas katalitiknya dan juga diaktifkan oleh hidrolisis proteolitik yang bergantung pada asam klorida.
Pepsinogen I disintesis dan disekresikan oleh sel utama dan sel fundus mukosa lambung. Oleh karena itu, sekresinya menurun pada pasien dengan gastritis atrofi kronis, penyakit lambung yang ditandai dengan hilangnya total kelenjar lambung.
Tidak seperti yang terakhir, pepsinogen II (PGII) disintesis oleh hampir semua sel yang merupakan bagian dari mukosa lambung, tetapi lebih menonjol oleh mukosa antral dan yang membentuk kelenjar Brünner yang ada di duodenum.
Pada pasien dengan gastritis atrofi kronis, pepsinogen jenis ini mengkompensasi penurunan sekresi pepsinogen I.
Keberadaan kedua jenis pepsinogen ini, yang hanya dibedakan dengan disekresikan oleh sel yang berbeda, tampaknya berlebihan. Namun, ini mungkin merupakan adaptasi evolusioner untuk memastikan sintesis pepsin bila diperlukan.
Pengaktifan
Pepsinogen memperoleh aktivitas katalitik ketika diubah menjadi pepsin, produk eliminasi dari 44 asam amino peptida yang ada di rongga situs aktif.
Fungsi optimalnya tergantung pada nilai pH rendah dalam kisaran 1,5 hingga 2. Dalam kondisi fisiologis, nilai-nilai ini dipertahankan oleh sekresi asam klorida di saluran intraseluler.
Pencernaan asam di tingkat lambung tidak terjadi pada semua hewan, contohnya serangga yang kekurangan pepsinogen. Namun, vertebrata yang memiliki perut memang memiliki aktivitas peptik.
Pepsinogen, yang disimpan dalam vesikel sekretori sel utama, dilepaskan ke saluran lambung bila diperlukan. Begitu mencapai lumen lambung, ia diubah menjadi pepsin dari lingkungan asam dan diaktifkan oleh lebih banyak molekul pepsinogen.
Dengan aksi serabut saraf intrinsik dan stimulasi vagal ekstrinsik, produksi pepsinogen dirangsang, serta produksi HCl, gastrin dan histamin. Di sisi lain, histamin dan gastrin merangsang sel parietal untuk mengeluarkan HCl.
Pepsin, seperti semua endopeptidase, bekerja pada ikatan spesifik antara asam amino dalam protein untuk menghasilkan peptida yang lebih kecil.
Dengan kata lain; menghidrolisis ikatan peptida internal protein. Tindakannya lebih efektif pada ikatan peptida yang dekat dengan asam amino aromatik (fenilalanin, tirosin). Tidak seperti zimogen induknya, perubahan adaptif pepsin pada nilai pH lebih besar dari 6 menghasilkan penurunan aktivitas katalitik yang ireversibel.
Referensi
- Bryksa BC, Tanaka T, Yada RY. Modifikasi N-terminal meningkatkan stabilitas pH netral pepsin. Biokimia. 2003; 42: 13331-13338.
- Foltmann B, Pedreson VB. Perbandingan struktur utama protease asam dan zimogennya. Adv Exp Med Biol 1977; 95: 3-22.
- Guyton A, Hall J. (2006). Buku Ajar Fisiologi Kedokteran. (edisi ke-11). AS: Elsevier Saunders.
- Kasper D, Fauci A, Longo D, Braunwald E, Hauser S, Jameson J. (2005). Harrison, Prinsip Penyakit Dalam. (16 edisi). Meksiko: McGrawHill.
- Kitahara F, Shimazaki R, Sato T, Kojima Y, Morozumi A, Fujino MA. Gastritis atrofi parah dengan infeksi Helicobacter pylori dan kanker lambung. Kanker lambung. 1998; 1: 118-124.
- Lin Y, Fused M, Lin X, Hartsuck JA, Tang J. pH ketergantungan parameter kinetik pepsin, Rhizopuspepsin dan mutan ikatan hidrogen situs aktif mereka. J Biol kimia. 1992; 267: 18413-18418.
- Mangeat P. Sekresi asam dan reorganisasi membran dalam sel parietal lambung tunggal dalam kultur primer. Sel biologi. 1990; 69: 223-257.
- Prozialeck J, Wershil BK. (2017). Perkembangan fungsi sekresi lambung. Fisiologi Janin dan Neonatus (Edisi Kelima). Jilid 1, hlm. 881-888.
- Schubert ML. Sekresi lambung. Opini Gastroent 2005; 21: 633-757.
- Sielecki AR, Fedorov AA, Boodhoo A, Andreeva NS, James MNG. Struktur molekul dan kristal pepsin babi monoklinik disempurnakan pada resolusi 1,8 . J Mol Biol.1990; 214: 143-170.
- Webb PM, Hengels KJ, Moller H, Newell DG, Palli D, Penatua JB. Epidemiologi kadar pepsinogen A serum yang rendah dan hubungan internasional dengan tingkat kanker lambung. Gastroenterologi. 1994; 107: 1335-1344.
- Wolfe MM, Soll AH. Fisiologi sekresi asam lambung. N Engl J Med 1998; 319: 1707.

