myosin adalah motor molekul, protein, mampu bergerak pada aktin filamen dalam sitosol. Energi yang mendorong perpindahan miosin berasal dari hidrolisis ATP. Karena itu, miosin sering didefinisikan sebagai enzim mekanokimia.
Pada eukariota, miosin adalah protein yang sangat melimpah. Ada berbagai kelas miosin, yang dikodekan oleh keluarga gen. Dalam ragi, 5 kelas dibedakan, sedangkan pada mamalia lusinan telah dijelaskan.
Sumber: David Richfield (Pengguna: Slashme) Saat menggunakan gambar ini dalam karya eksternal, dapat dikutip sebagai berikut: Richfield, David (2014). “Galeri medis David Richfield”. WikiJournal of Medicine 1 (2). DOI: 10.15347 / wjm / 2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0/)]
Myosin memiliki berbagai macam fungsi. Myosin I, bersama dengan aktin, berpartisipasi dalam pergerakan keratosit.
Myosin II memberikan kekakuan pada membran plasma, berpartisipasi dalam sitokinesis dan kontraksi otot. Baik miosin I dan II bekerja sama dengan migrasi sel. Miosin I dan V melakukan transportasi vesikel sepanjang filamen aktin.
Indeks artikel
Struktur
Dalam mikrograf elektron, struktur khas isoform miosin memiliki tiga domain: kepala, leher, dan ekor. Dengan hidrolisis dengan kimotripsin, segmen yang terdiri dari kepala dan leher, yang disebut meromiosin berat (HMM), dan segmen ekor, yang disebut meromiosin ringan (LMM) diperoleh.
Domain kepala adalah ujung terminal-N dari rantai berat, dan domain ekor adalah ujung terminal-C dari rantai ringan.
Kelas-kelas miosin dapat dibedakan berdasarkan jumlah rantai polipeptida yang menyusunnya, dan kelimpahan serta kelas rantai ringan yang melekat pada leher.
Myosin I memiliki rantai polipeptida, yang membentuk kepala dan ekornya tidak memiliki daerah alfa-heliks. Sementara miosin I dan V memiliki dua rantai polipeptida, dan karenanya membentuk dua kepala dan satu ekor, di mana rantai alfa-heliks melingkar membentuk struktur seperti batang.
Miosin I dan V memiliki situs pengikatan untuk kalmodulin, yang mengatur dan mengikat Ca +2 , pada rantai ringan. Myosin I mengikat Ca +2 ke rantai ringan, tetapi cara kerjanya berbeda dengan kalmodulin.
Karakteristik
Pada tingkat mekanokimia, miosin memiliki tiga karakteristik, yaitu:
– Kepala miosin adalah domain motorik yang maju dalam langkah-langkah terpisah: Penyatuan kepala miosin ke filamen aktin, kemiringannya dan pemisahan selanjutnya menghasilkan pergerakan miosin. Proses ini bersifat siklis dan bergantung pada ATP.
– Perubahan konformasi: hidrolisis molekul ATP digabungkan ke setiap langkah molekul miosin, melalui tingkat amplifikasi dan transmisi. Ini melibatkan perubahan konformasi besar dalam miosin.
Tingkat pertama amplifikasi dihasilkan oleh hilangnya gugus gamma-fosfat ATP, yang memungkinkan reorganisasi unsur struktural di situs pengikatan ATP. Penataan ulang ini dikoordinasikan dengan perubahan struktural di situs pengikatan aktin.
Tingkat kedua amplifikasi melibatkan komunikasi perubahan konformasi di situs aktif untuk komponen struktural terminal karboksil.
– Directionality: miosin telah ditemukan memiliki polaritas, atau arah terbalik, menuju ujung (+) filamen aktin. Kesimpulan ini berasal dari percobaan slip filamen aktin, menggunakan mikroskop cahaya fluoresensi.
Fitur
Myosin, bersama dengan aktin, berpartisipasi dalam kontraksi otot, adhesi sel, sitokinesis, pengerasan membran kortikal dan perpindahan beberapa vesikel, di antara fungsi lainnya.
Cacat pada miosin dapat menghasilkan kondisi patologis. Misalnya, defek pada miosin I dan V masing-masing terkait dengan miopati miosin dan gangguan pigmentasi (sindrom Griscelli). Sedangkan kelainan pada isoform miosin VI menyebabkan gangguan pendengaran.
Kontraksi otot
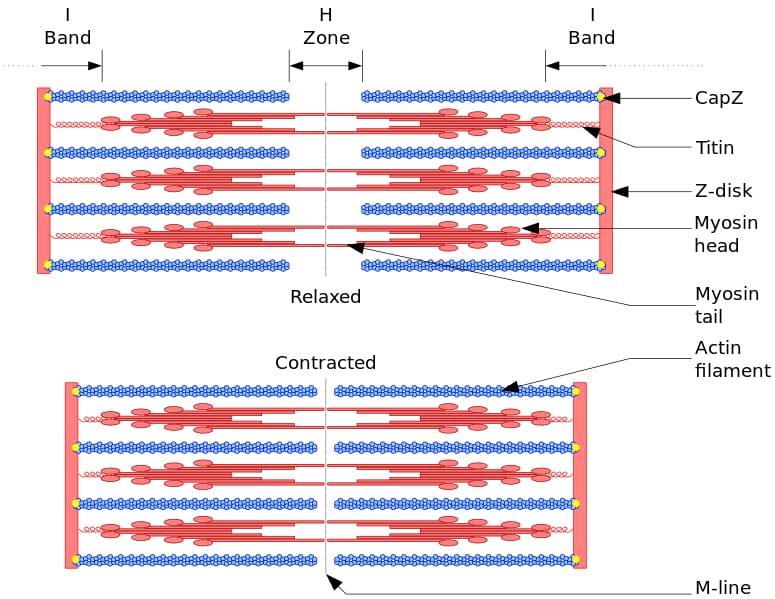
Unit fungsional dan struktural otot rangka adalah sarkomer. Selama kontraksi otot, panjang sarkomer mencapai 30% dari panjang aslinya.
Sarkomer terdiri dari filamen miosin tebal dan filamen aktin tipis yang tersusun secara kompleks. Secara umum, kepala miosin terletak di ujung distal filamen dan ekornya menuju pusat sarkomer, dan organisasinya adalah bipolar.
Agar kontraksi otot terjadi, kepala miosin pada ujung yang berlawanan harus bergerak menuju cakram Z atau ujung (+) filamen. Karena susunan filamen tebal adalah bipolar, geseran filamen tipis pada filamen tebal terjadi, didorong oleh ATP.
Gaya perpindahan terjadi karena ratusan kepala miosin filamen tebal berinteraksi dengan filamen tipis.
Sitokinesis
Selama mitosis, ketika mikrotubulus di kutub gelendong terpisah, aktin dan miosin II membentuk cincin kontraktil di ekuator sel. Cincin ini berkontraksi, mengecilkan diameternya dan membagi sel menjadi dua bagian.
Kekakuan membran kortikal
Pada sel mutan yang kekurangan miosin II, membran plasma dengan mudah berubah bentuk ketika gaya eksternal diterapkan. Hal ini terjadi karena miosin II memberikan gaya agregasi pada protein membran plasma.
Adhesi sel
Pada jaringan epitel, ikatan kontraktil aktin dan miosin II terletak di sekitar membran plasma, dan membentuk korset melingkar yang mengelilingi permukaan sel bagian dalam. Korset melingkar ini menentukan bentuk sel dan mempertahankan ikatan antar sel.
Kontak antar sel terjadi melalui penyatuan korset sirkular dengan molekul adhesi seluler, melalui penyatuan protein.
Perpindahan beberapa vesikel
Bukti eksperimental mengungkapkan bahwa miosin V melakukan transpor membran dari aparatus Golgi ke perifer sel. Beberapa buktinya adalah:
– Pada sel jaringan saraf, dengan imunofluoresensi astrosit ditemukan bahwa miosin V terletak di sebelah Golgi.
– Pada ragi, mutasi pada gen miosin V mengganggu sekresi protein dan, akibatnya, protein menumpuk di sitosol.
– Isoform miosin I bertanggung jawab untuk transportasi vakuola menuju membran sel. Menggunakan antibodi spesifik terhadap isoform miosin I, ditemukan bahwa isoform ini terletak di bagian sel yang berbeda.
Misalnya, ketika amuba hidup diberi label dengan antibodi terhadap myosin IC, pengangkutan vakuola ke membran dihentikan. Karena itu, vakuola mengembang dan sel pecah.
Penyakit terkait miosin
Miosin dan gangguan pendengaran
Ada banyak gen dan mutasi yang menyebabkan gangguan pendengaran. Penyakit ini sering bersifat monogenetik.
Mutasi miosin yang tidak biasa, dengan satu atau dua kepala miosin, mempengaruhi fungsi telinga bagian dalam. Beberapa isoform miosin yang bermutasi adalah miosin IIIA, miosin VIIA, dan miosin XVA. Baru-baru ini, dua mutasi ditemukan pada myosin VI.
Mutasi pada miosin VI adalah c.897G> T dan p.926Q. Mutasi pertama mempengaruhi wilayah yang berinteraksi dengan situs aktif, yang disebut Switch I. Homozigot untuk mutasi menunjukkan fenotipe awal, menyebabkan efek yang parah.
Mutasi kedua mempengaruhi wilayah residu bermuatan, dalam heliks alfa di ekor miosin VI. Daerah ini penting untuk dimerisasi motorik proksimal, dan mempengaruhi fungsi stereo-siliar miosin VI.
Mutasi lain adalah p.Asn207Ser, yang menghasilkan motor yang tidak mampu menghasilkan tenaga. Hal ini karena Asn 207 merupakan residu asam amino dari situs aktif, yang fungsinya adalah pengikatan dan hidrolisis ATP.
Mutasi p.Arg657Trp menyebabkan hilangnya fungsi myosin VI. Residu Arg terlibat dalam perubahan konformasi yang menggabungkan hidrolisis dengan pergerakan miosin.
Myosin X dan kanker
Myosin X (Myo10) adalah miosin tidak konvensional yang diekspresikan di otak, endotelium, dan banyak epitel. Myo10 dan tiga kelas proyeksi berbasis aktin (filopodia, invadopodia, dan proyeksi seperti filopodia) bekerja selama metastasis kanker.
Sel kanker invasif memiliki sejumlah besar filopodia dan mengekspresikan tingkat fascina yang tinggi. Protein ini membuat ikatan silang antara filamen aktin. Untuk menghindari tumor primer, invadopodia terbentuk, kaya akan aktivitas proteolitik, yang mencerna matriks ekstraseluler di sekitarnya.
Setelah sel mencapai matriks ekstraseluler, proyeksi seperti filopodia membantu untuk membubarkan dan menjajah. Kadar Myo10 yang tinggi menunjukkan agresivitas dan metastasis yang tinggi pada kanker payudara.
Pembungkaman MyoX menghasilkan hilangnya karakter metastasis sel, yang tidak dapat membentuk proyeksi berbasis aktin. Semua proyeksi ini memiliki adhesi berbasis integrin, yang dibawa oleh Myo10 dalam filopodium.
MyoX terlibat dalam pembentukan sentrosom. Tidak adanya MyoX mendukung pembentukan spindel multipolar. MyoX juga terlibat dalam pensinyalan dalam sel kanker. Misalnya, MyoX diaktifkan oleh 3,4,5, -inositol triphosphate (PIP3).
Referensi
- Alberts, B., Johnson, A., Lewis, J., dkk. 2007. Biologi Molekuler Sel. Ilmu Garland, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Mutasi miosin baru untuk gangguan pendengaran herediter diungkapkan oleh penangkapan genomik yang ditargetkan dan sekuensing paralel besar-besaran. Jurnal Genetika Manusia Eropa, 22: 768-775.
- Courson, DS dan Cheney, RE 2015. Myosin-X dan Penyakit. Penelitian Sel Eksperimental, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, SL, Matsudaria, P., Baltimore, D., Darnell, J. 2003. Seluler dan biologi molekuler. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Schliwa, M. dan Woehlke, G. 2003. Motor molekuler. Alam, 422: 759-765.
- Vale, RD 2003. Toolbox Motor Molekul untuk Transportasi Intraseluler. Sel, 112: 467-480.

