maltase , juga dikenal sebagai α-glucosidase, asam maltase, invertase glukosa, glucosidosucrasa, α-glucosidase lisosom atau maltase-glukoamilase adalah enzim yang bertanggung jawab untuk hidrolisis maltosa dalam sel epitel usus selama langkah akhir pencernaan pati.
Ini termasuk kelas hidrolase, khususnya subkelas glikosidase, yang mampu memutuskan ikatan -glukosidik antara residu glukosa (EC. 3.2.1.20). Kategori ini mengelompokkan berbagai enzim yang spesifisitasnya diarahkan pada ekso-hidrolisis glukosida terminal yang dihubungkan oleh ikatan -1,4.
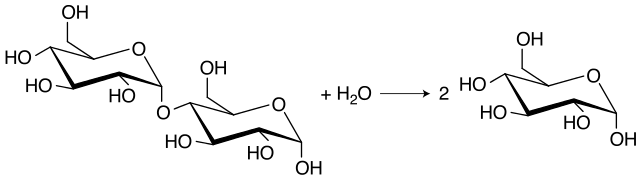
Reaksi yang dikatalisis maltase. Di sebelah kiri satu molekul maltosa dan di sebelah kanan dua molekul glukosa hasil hidrolisis (Sumber: Dapantazis [CC BY-SA 3.0 (httpscreativecommons.orglicensesby-sa3.0)]. Jpg via Wikimedia Commons)
Beberapa maltase mampu menghidrolisis polisakarida , tetapi pada tingkat yang jauh lebih lambat. Secara umum, setelah aksi maltase, residu -D-glukosa dilepaskan, namun, enzim dari subkelas yang sama dapat menghidrolisis -glukan, sehingga melepaskan residu -D-glukosa.
Keberadaan enzim maltase awalnya ditunjukkan pada tahun 1880 dan sekarang diketahui tidak hanya terdapat pada mamalia , tetapi juga pada mikroorganisme seperti ragi dan bakteri , serta pada banyak tanaman tingkat tinggi dan sereal.
Contoh pentingnya aktivitas enzim ini terkait dengan Saccharomyces cerevisiae , mikroorganisme yang bertanggung jawab untuk produksi bir dan roti, yang mampu mendegradasi maltosa dan maltotriosa berkat fakta bahwa ia memiliki enzim maltosa, yang produknya dimetabolisme ke dalam produk fermentatif khas organisme ini.
Indeks artikel
Karakteristik
Pada mamalia
Maltase adalah protein amfipatik yang terkait dengan membran sel sikat usus. Sebuah isoenzim yang dikenal sebagai asam maltase juga dikenal, terletak di lisosom dan mampu menghidrolisis berbagai jenis ikatan glikosidik pada substrat yang berbeda, tidak hanya maltosa dan ikatan -1,4. Kedua enzim memiliki banyak karakteristik struktural.
Enzim lisosom memiliki panjang sekitar 952 asam amino dan diproses pasca-translasi melalui glikosilasi dan penghilangan peptida pada ujung-N dan C-termini.
Studi yang dilakukan dengan enzim dari usus tikus dan babi menetapkan bahwa pada hewan ini enzim terdiri dari dua subunit yang berbeda satu sama lain dalam beberapa sifat fisik. Kedua subunit ini muncul dari prekursor polipeptida yang sama yang dibelah secara proteolitik.
Tidak seperti babi dan tikus, enzim pada manusia tidak memiliki dua subunit, tetapi merupakan satu, berat molekul tinggi dan sangat glikosilasi (oleh N- dan O- glikosilasi).
Dalam ragi
Maltase ragi, dikodekan oleh gen MAL62 , beratnya 68 kDa dan merupakan protein sitoplasma yang ada sebagai monomer dan menghidrolisis spektrum -glukosida yang luas.
Dalam ragi ada lima isoenzim yang dikodekan di zona telomerik dari lima kromosom yang berbeda. Setiap lokus pengkode gen MAL juga terdiri dari kompleks gen dari semua gen yang terlibat dalam metabolisme maltosa, termasuk permease dan protein pengatur, seolah-olah itu adalah operon.
Pada tumbuhan
Enzim yang ada pada tanaman telah terbukti sensitif terhadap suhu di atas 50 ° C dan maltase itu terdapat dalam jumlah besar pada sereal yang bertunas dan tidak bertunas.
Selain itu, selama degradasi pati, enzim ini spesifik untuk maltosa, karena tidak bekerja pada oligosakarida lain, tetapi selalu berakhir dengan pembentukan glukosa.
Perpaduan
Pada mamalia
Maltase usus manusia disintesis sebagai rantai polipeptida tunggal. Karbohidrat yang kaya akan residu manosa ditambahkan secara ko-translasi melalui glikosilasi, yang tampaknya melindungi urutan dari degradasi proteolitik.
Studi tentang biogenesis enzim ini menetapkan bahwa ia dirakit sebagai molekul dengan berat molekul tinggi dalam keadaan “terikat membran” retikulum endoplasma , dan selanjutnya diproses oleh enzim pankreas dan “terglikosilasi ulang” di kompleks Golgi .
Dalam ragi
Dalam ragi ada lima isoenzim yang dikodekan di zona telomerik dari lima kromosom yang berbeda. Setiap lokus pengkode gen MAL juga terdiri dari kompleks gen dari semua gen yang terlibat dalam metabolisme maltosa, termasuk protein permease dan pengatur.
Pada bakteri
Sistem metabolisme maltosa pada bakteri, seperti E. coli , sangat mirip dengan sistem laktosa, terutama dalam organisasi genetik operon yang bertanggung jawab untuk sintesis protein pengatur, pengangkut dan enzim aktif pada substrat (maltase).
Fitur
Pada sebagian besar organisme di mana keberadaan enzim seperti maltase telah terdeteksi, enzim ini memainkan peran yang sama: degradasi disakarida seperti maltosa untuk mendapatkan produk karbohidrat larut yang lebih mudah dimetabolisme.
Di usus mamalia, maltase memainkan peran kunci dalam langkah akhir degradasi pati. Kekurangan enzim ini umumnya diamati dalam kondisi seperti glikogenosis tipe II, yang terkait dengan penyimpanan glikogen.
Pada bakteri dan khamir, reaksi yang dikatalisis oleh enzim jenis ini merupakan sumber energi penting dalam bentuk glukosa yang memasuki jalur glikolitik, dengan atau tanpa tujuan fermentasi.
Pada tumbuhan, maltase, bersama dengan amilase, berpartisipasi dalam degradasi endosperma dalam biji yang “tertidur”, dan yang diaktifkan oleh giberelin, hormon pengatur pertumbuhan tanaman, sebagai prasyarat untuk perkecambahan.
Selain itu, banyak tanaman penghasil pati sementara di siang hari memiliki maltase spesifik yang berkontribusi pada pemecahan zat antara dalam metabolisme mereka di malam hari, dan kloroplas telah ditemukan sebagai tempat penyimpanan maltosa utama dalam organisme ini.
Referensi
- Auricchio, F., Bruni, CB, & Sica, V. (1968). Pemurnian Lebih Lanjut dan Karakterisasi Asam a-Glucosidase. Jurnal Biokimia , 108 , 161-167.
- Danielsen, EM, Sjostrom, H., & Noren, O. (1983). Biosintesis protein mikrovillar usus. Jurnal Biokimia , 210 , 389-393.
- Davis, WA (1916). AKU AKU AKU. Distribusi maltase pada tumbuhan. Fungsi maltase dalam degradasi pati dan pengaruhnya terhadap aktivitas amiloklastik bahan tanaman. Jurnal Biokimia , 10 (1), 31–48.
- ExPASy. Portal Sumber Daya Bioinformatika. (dan). Diperoleh dari enzyme.expasy.org
- Lu, Y., Gehan, JP, & Sharkey, TD (2005). Panjang Hari dan Efek Sirkadian pada Degradasi Pati dan Metabolisme Maltosa. Fisiologi Tumbuhan , 138 , 2280–2291.
- Naims, HY, Sterchi, EE, & Lentze, MJ (1988). Struktur, Biosintesis, dan Glikosilasi Usus Kecil Manusia. Jurnal Kimia Biologi , 263 (36), 19709-19717.
- Needleman, R. (1991). Kontrol sintesis maltase dalam ragi. Mikrobiologi Molekuler , 5 (9), 2079–2084.
- Komite Nomenklatur Persatuan Internasional Biokimia dan Biologi Molekuler (NC-IUBMB). (2019). Diperoleh dari qmul.ac.uk.
- Reuser, A., Kroos, M., Hermans, M., Bijvoet, A., Verbeet, M., Van Diggelen, O.,… Ploeg, V. der. (sembilan belas sembilan puluh lima). Glikogenosis tipe II (Defisiensi Asam Maltase). Otot & Saraf , 3 , 61–69.
- Simpson, G., & Naylor, J. (1962). Studi dormansi pada benih Avena fatua. Jurnal Botani Kanada , 40 (13), 1659–1673.
- Sorensen, S., Norén, O., Stostrom, H., & Danielsen, M. (1982). Amphiphilic Pig Intestinal Microvillus Maltase / Glucoamylase Struktur dan Spesifisitas. Jurnal Biokimia Eropa , 126 , 559-568.

