Bowman ‘s kapsul merupakan segmen awal komponen tubular dari nefron, unit anatomo-fungsional ginjal yang dilakukan proses untuk produksi urine dengan yang berkontribusi ginjal untuk pelestarian homeostasis organisme.
Itu dinamai untuk menghormati dokter mata dan ahli anatomi Inggris Sir William Bowman, yang menemukan keberadaannya dan menerbitkan deskripsi histologisnya untuk pertama kalinya pada tahun 1842.
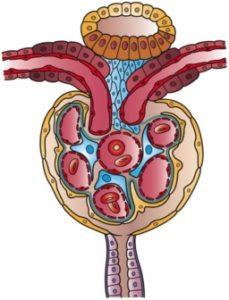
Ilustrasi nefron (Sumber: Artwork oleh Holly Fischer [CC BY 3.0 (https://creativecommons.org/licenses/by/3.0)] melalui Wikimedia Commons)
Ada beberapa kebingungan dalam literatur mengenai nomenklatur segmen awal nefron, termasuk kapsul Bowman. Kadang-kadang digambarkan sebagai bagian yang berbeda dari glomerulus dan dengannya membentuk sel darah ginjal, sedangkan untuk yang lain berfungsi sebagai anggota glomerulus.
Terlepas dari apakah dalam deskripsi anatomi kapsul merupakan bagian atau merupakan bagian dari glomerulus, faktanya adalah bahwa kedua unsur tersebut sangat erat terkait dalam struktur dan fungsinya, sehingga istilah glomerulus terbangun pada mereka yang memikirkannya. bola kecil dengan bejananya. .
Jika tidak, kapsul hanya akan menjadi wadah di mana cairan yang disaring dituangkan ke dalam glomerulus, tetapi tidak akan memiliki bagian dalam proses filtrasi glomerulus itu sendiri. Yang tidak terjadi, karena, seperti yang akan dilihat, adalah bagian dari proses yang disumbangkannya dengan cara yang khusus.
Indeks artikel
Struktur dan histologi
Kapsula Bowman seperti bola kecil yang dindingnya berinvaginasi ke dalam sektor vaskular. Dalam invaginasi ini, kapsul ditembus oleh bola kapiler, yang berasal dari arteriol aferen dan yang mensuplai darah ke glomerulus, dari mana arteriol eferen juga keluar, yang menarik darah dari glomerulus.
Ujung kapsul yang berlawanan, yang disebut kutub urinarius, tampak seolah-olah dinding bola memiliki lubang di mana ujung segmen pertama yang memulai fungsi tubulus sebenarnya, yaitu tubulus kontortus proksimal, terhubung.
Dinding luar kapsul ini adalah epitel datar dan disebut epitel parietal kapsul Bowman. Ini berubah dalam struktur dengan transisi ke epitel tubulus proksimal di kutub kemih dan ke epitel visceral di kutub vaskular.
Epitel invaginat disebut viseral karena mengelilingi kapiler glomerulus seolah-olah merupakan visera. Itu terdiri dari sel-sel yang disebut podosit yang memeluk, menutupi mereka, kapiler dan memiliki karakteristik yang sangat khusus.
Podosit diatur dalam satu lapisan, memancarkan ekstensi yang interdigitate dengan ekstensi podosit tetangga, meninggalkan ruang di antara mereka yang disebut pori-pori celah atau celah filtrasi, yang merupakan solusi kontinuitas untuk lewatnya filtrat.
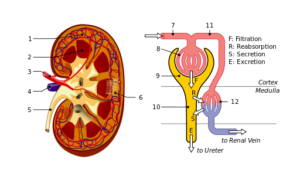
Struktur ginjal dan nefron: 1. Korteks ginjal; 2. Sumsum; 3. Arteri ginjal; 4. Vena ginjal; 5. Ureter; 6. Nefron; 7. Arteriol aferen; 8. Glomerulus; 9. Kapsul Bowman; 10. Tubulus dan bundel Henle; 11. Kapiler peritubular (Sumber: File: Physiology_of_Nephron.svg: Madhero88File: KidneyStructures_PioM.svg: Piotr Michał Jaworski; PioM EN DE PL Karya turunan: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https://creativecommons. /by-sa/3.0)] melalui Wikimedia Commons)
Podosit dan sel endotel yang ditutupinya mensintesis membran basal tempat mereka beristirahat dan yang juga memiliki solusi kontinuitas untuk lewatnya air dan zat. Sel-sel endotel berfenestrasi dan juga memungkinkan filtrasi.
Jadi ketiga unsur ini: endotel kapiler, membran basal dan epitel viseral kapsula Bowman, bersama-sama membentuk membran atau penghalang filtrasi.
Fitur
Kapsul berhubungan dengan proses filtrasi glomerulus. Di satu sisi, karena merupakan bagian dari penutup epitel podosit yang mengelilingi kapiler glomerulus. Ini juga berkontribusi pada sintesis membran basal tempat epitel ini dan endotel kapiler glomerulus beristirahat.
Ketiga struktur ini: endotel kapiler, membran basal dan epitel viseral kapsula Bowman, membentuk apa yang disebut membran filtrasi atau penghalang, dan masing-masing memiliki karakteristik permeabilitasnya sendiri yang berkontribusi pada selektivitas keseluruhan penghalang ini.
Selain itu, volume cairan yang menembus ruang Bowman, bersama dengan tingkat kekakuan yang menentang dinding luar kapsul, menentukan asal-usul tekanan intrakapsular yang membantu memodulasi tekanan filtrasi efektif dan mendorong cairan sepanjang tubulus terkait.
Penentu besarnya filtrasi glomerulus
Variabel yang mengumpulkan besarnya proses filtrasi glomerulus disebut volume filtrasi glomerulus (GFR), yaitu volume cairan yang disaring melalui semua glomerulus dalam satuan waktu. Nilai normal rata-ratanya adalah sekitar 125 ml/menit atau 180 L/hari.
Besarnya variabel ini ditentukan dari sudut pandang fisik oleh dua faktor, yaitu yang disebut koefisien filtrasi atau ultrafiltrasi (Kf) dan tekanan filtrasi efektif (Peff). Yaitu: VFG = Kf x Peff (persamaan 1)
Koefisien filtrasi (Kf)
Koefisien filtrasi (Kf) adalah produk dari konduktivitas hidrolik (LP), yang mengukur permeabilitas air membran dalam ml / menit per satuan luas dan satuan tekanan penggerak, kali luas permukaan (A) membran penyaringan, yaitu, Kf = LP x A (persamaan 2).
Besarnya koefisien filtrasi menunjukkan volume cairan yang disaring per satuan waktu dan per satuan tekanan penggerak efektif. Meskipun sangat sulit untuk mengukur secara langsung, dapat diperoleh dari persamaan 1, membagi VFG / Peff.
Kf di kapiler glomerulus adalah 12,5 ml / menit / mmHg per c / 100g jaringan, nilai sekitar 400 kali lebih tinggi dari Kf sistem kapiler lain di tubuh, di mana sekitar 0,01 ml / ml dapat disaring. min / mm Hg per 100 gram jaringan. Perbandingan menunjukkan efisiensi penyaringan glomerulus.
Tekanan filtrasi efektif (Peff)
Tekanan filtrasi efektif menunjukkan hasil penjumlahan aljabar dari berbagai gaya tekanan yang mendukung atau menentang filtrasi. Ada gradien tekanan hidrostatik (ΔP) dan gradien tekanan osmotik (onkotik, ) yang ditentukan oleh adanya protein dalam plasma.
Gradien tekanan hidrostatik adalah perbedaan tekanan antara bagian dalam kapiler glomerulus (PCG = 50 mm Hg) dan ruang kapsul Bowman (PCB = 12 mm Hg). Seperti dapat dilihat, gradien ini diarahkan dari kapiler ke kapsul dan mendorong perpindahan cairan ke arah itu.
Gradien tekanan osmotik memindahkan cairan dari tekanan osmotik yang lebih rendah ke yang lebih tinggi. Hanya partikel yang tidak menyaring yang memiliki efek ini. Protein tidak menyaring. CB-nya adalah 0 dan di kapiler glomerulus CG adalah 20 mm Hg. Gradien ini memindahkan cairan dari kapsul ke kapiler.
Tekanan efektif dapat dihitung dengan menerapkan Peff = P – ; = (PCG-PCB) – (ПCG-ПCB); = (50-12) – (20-0); = 38-20 = 18 mm Hg. Jadi, ada tekanan filtrasi efektif atau bersih sekitar 18 mm Hg yang menentukan GFR sekitar 125 ml / menit.
Indeks filtrasi (IF) zat yang ada dalam plasma
Ini adalah indikator kemudahan (atau kesulitan) dimana suatu zat dalam plasma dapat melewati penghalang filtrasi. Indeks diperoleh dengan membagi konsentrasi zat dalam filtrat (FX) dengan konsentrasinya dalam plasma (PX), yaitu: IFX = FX / PX.
Kisaran nilai IF adalah antara maksimum 1 untuk zat yang menyaring secara bebas, dan 0 untuk zat yang tidak menyaring sama sekali. Nilai antara adalah untuk partikel dengan kesulitan menengah. Semakin mendekati 1 nilainya, semakin baik penyaringannya. Semakin mendekati 0, semakin sulit menyaring.
Salah satu faktor yang menentukan IF adalah ukuran partikel. Mereka yang berdiameter lebih kecil dari 4 nm menyaring secara bebas (IF = 1). Sebagai ukuran tumbuh lebih dekat dengan albumin, IF menurun. Partikel berukuran albumin atau lebih besar memiliki IF 0.
Faktor lain yang berkontribusi untuk menentukan IF adalah muatan listrik negatif pada permukaan molekul. Protein bermuatan sangat negatif, yang menambah ukurannya sehingga sulit untuk menyaringnya. Alasannya adalah pori-pori memiliki muatan negatif yang menolak muatan protein.
Referensi
- Ganong WF: Fungsi Ginjal dan Mikturisi, dalam Review of Medical Physiology , 25th ed. New York, Pendidikan McGraw-Hill, 2016.
- Guyton AC, Hall JE: Urinary System, in Textbook of Medical Physiology , 13th ed, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, dalam Physiologie des Menschen mit Patophysiologie , edisi ke-31, RF Schmidt dkk (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funktion der nieren, dalam Physiologie , edisi ke-6; R Klinke dkk (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl RAK dkk: Niere undableitende Harnwege, dalam Klinische Patophysiologie , edisi ke-8, W Siegenthaler (ed). Stuttgart, Georg Thieme Verlag, 2001.

