histidin (Nya, H) adalah asam amino yang digunakan untuk sintesis protein. Ini adalah molekul hidrofilik, sehingga umumnya berorientasi ke luar struktur protein ketika mereka berada dalam media cair.
Ini dianggap sebagai asam amino esensial untuk pertumbuhan anak karena mereka tidak memproduksinya. Pada orang dewasa terdapat sedikit produksi histidin, tetapi tidak mencukupi untuk memenuhi kebutuhan sehari-hari, oleh karena itu dianggap sebagai asam amino semi esensial.
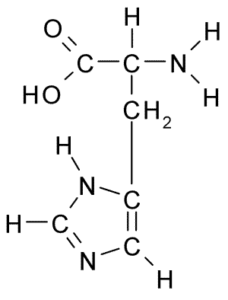
Struktur kimia asam amino Histidin (Sumber: Borb, melalui Wikimedia Commons)
Untuk hewan dan manusia, histidin adalah asam amino esensial atau setidaknya semi esensial, namun tanaman , jamur dan mikroorganisme secara efisien menghasilkan histidin yang mereka butuhkan dan merupakan bagian dari sumber makanan histidin, selain protein hewan.
Histidin memenuhi fungsi fisiologis yang sangat penting pada manusia, seperti: menjadi bagian dari pusat aktif banyak enzim, berpartisipasi dalam pertumbuhan, dalam sistem kekebalan dan dalam pembentukan mielin di serabut saraf, antara lain.
Biosintesis histidin adalah proses kompleks yang terjadi terutama di hati dan membutuhkan 9 hingga 11 langkah enzimatik. Degradasinya terjadi di hati dan kulit dan melalui pembentukan glutamat, kemudian mengikuti rute yang berbeda.
Banyak makanan yang kaya akan histidin, seperti protein hewani seperti daging dan produk susu, serta protein nabati. Ini menyediakan sebagian besar kebutuhan histidin harian yang dibutuhkan tubuh kita untuk berfungsi dengan baik.
Kekurangan atau kelebihan histidin yang disebabkan oleh masalah metabolisme atau transportasi herediter, atau kegagalan asupan makanan, terkait dengan beberapa masalah penting yang mempengaruhi kesehatan baik pada anak-anak maupun orang dewasa. Asupan histidin yang cukup memungkinkan Anda untuk mempertahankan hidup yang sehat dan sehat dalam banyak kasus.
Indeks artikel
Karakteristik
Sebuah fitur mencolok dari histidin adalah bahwa hal itu dapat diubah menjadi histamin, zat yang secara aktif terlibat dalam banyak reaksi alergi dan inflamasi.
Pada ikan yang terpapar lingkungan tanpa pendinginan yang cukup, bakteri dapat mengubah histidin menjadi histamin dan itulah sebabnya, ketika tertelan, mereka menyebabkan keracunan makanan.
Karakteristik lain dari asam amino ini adalah bahwa ia adalah salah satu dari sedikit, di antara 22 asam amino yang ada, yang terionisasi dalam kisaran pH fisiologis (sekitar 7,4) dan, oleh karena itu, dapat secara aktif berpartisipasi dalam situs katalitik banyak enzim.
Dalam molekul hemoglobin, histidin proksimal adalah salah satu ligan dari kelompok heme. Dengan kata lain, asam amino ini berpartisipasi dalam fungsi transportasi oksigen hemoglobin dan sangat penting untuk sintesis protein ini, serta untuk mioglobin, yang juga dikenal sebagai “hemoglobin otot”.
Struktur
Histidin adalah asam amino hidrofilik polar dasar , diklasifikasikan dalam asam amino esensial, karena tidak dapat disintesis oleh hewan. Namun, dan seperti yang disebutkan sebelumnya, itu disintesis oleh bakteri, jamur, dan tanaman.
Pada anak-anak yang sedang tumbuh, histidin mutlak diperlukan; orang dewasa dapat mensintesisnya, tetapi tidak jelas apakah ini memenuhi kebutuhan histidin harian, sehingga harus dikonsumsi bersama makanan.
Seperti semua asam amino, histidin memiliki karbon-α yang mengikat gugus amino, gugus karboksil, atom hidrogen, dan rantai samping.
Rantai samping asam amino ini dibentuk oleh cincin imidazol yang, pada pH fisiologis, terprotonasi dan memperoleh muatan positif dan disebut ” imidazolium” disingkat ImH +.
Bersama dengan lisin dan arginin, histidin membentuk kelompok asam amino dasar. Dari ketiganya, histidin adalah yang paling basa dan cincin imidazolnya dapat terdeprotonasi pada pH mendekati 6.
Karena pada pH fisiologis histidin dapat bertukar proton, ia cenderung berpartisipasi dalam katalisis enzimatik yang melibatkan transfer proton. Selain itu, karena merupakan asam amino polar, biasanya ditemukan di permukaan luar protein, di mana ia dapat terhidrasi dalam media berair.
Fitur
Sebagai bagian dari situs aktif enzim
Histidin diperlukan untuk sintesis banyak protein, terutama enzim yang pusat aktifnya memiliki asam amino ini dalam strukturnya. Ini adalah bagian dari pusat aktif aldolase mamalia, di mana ia berfungsi sebagai donor proton.
Ini ditemukan di pusat aktif karboksipeptidase A, enzim pankreas yang memiliki situs aktif yang terdiri dari Zn dan histidin. Dalam enzim glikolitik fosfogliserat mutase, ada dua residu histidin di pusat aktifnya yang bertindak sebagai akseptor atau donor gugus fosforil.
Hal ini juga ditemukan di situs aktif enzim seperti gliseraldehida 3-fosfat dehidrogenase, dehidrogenase laktat, papain, chymotrypsin, RNase A, dan histidin amonia liase (histidase). Selanjutnya, ini adalah penghambat alosterik enzim glutamin sintetase.
Fungsi lainnya
Asam amino ini sangat penting bagi tubuh, karena dekarboksilasinya oleh histidin dekarboksilase menghasilkan histamin, suatu vasodilator kuat yang berhubungan dengan reaksi inflamasi dan alergi, terdapat di usus dan granula sel dari sistem fagositik mononuklear.
Histidin diproduksi oleh neuron sistem saraf pusat dengan fungsi neuromodulator.
Hal ini diperlukan untuk pembentukan selubung mielin serabut saraf, sehingga memainkan peran penting dalam transmisi impuls listrik di dalamnya.
Seiring dengan hormon pertumbuhan dan asam amino lainnya, histidin berkontribusi pada mekanisme perbaikan jaringan, terutama dalam sistem kardiovaskular.
Beberapa fitur tambahan meliputi:
– Berkontribusi pada detoksifikasi beberapa logam berat karena bertindak sebagai chelator.
– Melindungi dari kerusakan radiasi.
– Berpartisipasi dalam pembentukan sel darah merah dan putih.
– Hal ini diperlukan untuk pembentukan hemoglobin.
– Membantu memerangi beberapa efek negatif dari rheumatoid arthritis seperti peradangan dan kurangnya mobilitas.
– Ini adalah asam amino penting untuk regenerasi rambut, pertumbuhan dan fungsi seksual.
Carnosine, anserine, dan homocarnosine adalah dipeptida yang terbentuk dari histidin. Dua yang pertama ditemukan di otot dan memiliki fungsi penting sebagai buffer dan sebagai aktivator myosin ATPase.
Homocarnosine diproduksi di otak dalam jumlah 100 kali lebih besar dari carnosine di otot rangka.
Biosintesis
Histidin mendapatkan kerangka karbonnya dari ribosa 5-fosfat. Pada bakteri E. Coli , asam amino ini dihasilkan dari senyawa tersebut melalui 11 langkah enzimatik:
- Langkah pertama sintesis terdiri dari transfer fosforibosil dari ATP ke karbon 1 ribosa 5-fosfat, menghasilkan 5-fosforibosil-1-pirofosfat (PRPP). Enzim fosforibosil pirofosfat sintetase (PRPP sintetase) mengkatalisis reaksi ini.
- Kemudian terjadi transfer gugus pirofosfat dari karbon 1 ke N-1 ATP, dan dihasilkan N1- (5′-phosphoribosyl) -ATP. Enzim yang mengkatalisis reaksi ini adalah ATP phosphoribosyltransferase.
- Dengan aksi fosforibosil-ATP-pirofosfat hidroksilase, ikatan , -pirofosfat ATP dihidrolisis dan N1- (5′-fosforibosil) -AMP terbentuk.
- Enzim phosphoribosyl-AMP cyclo hydroxylase membuka cincin purin antara N-1 dan C-6 dan ribonukleotida N1- (5′-phosphoribosyl formimino) -5-aminoimidazole-4-carboxamide-1-ribonucleotide terbentuk.
- Kemudian, cincin ribofuranosa yang berasal dari PRPP terbuka dan diisomerisasi menjadi ketosa, membentuk N1- (5′-phosphoribosyl formimino) -5-aminoimidazole-4-carboxamide-1-ribonucleotide oleh efek enzim isomerase.
- Enzim aminotransferase mentransfer gugus amido dari glutamin, yang diubah menjadi glutamat, dan memutus ikatan formimino, sehingga melepaskan 5-aminoimidazole-carboxamide-1-ribonucleotide dan menghasilkan imidazol gliserol fosfat.
- Sebuah molekul air dihilangkan dari imidazol gliserol fosfat melalui imidazol gliserol fosfat dehidratase dan imidazol asetol fosfat terbentuk.
- Gugus amino ditransfer ke imidazol asetol fosfat melalui histidinol fosfat transaminase dan histidinol fosfat terbentuk.
- Gugus ester fosfat dari histidinol fosfat dihidrolisis menjadi histidinol. Histidinol fosfat fosfatase mengkatalisis reaksi ini.
- Kemudian, histidinol dioksidasi oleh histidinol dehidrogenase dan histidinal terbentuk.
- Histidinol dehidrogenase sendiri mengoksidasi histidinal dan mengubahnya menjadi histidin.
Enzim pertama dari jalur biosintesis histidin dihambat oleh produk jalur, yaitu histidin berpartisipasi dalam penghambatan alosterik ATP phosphoribosyltransferase, yang mewakili mekanisme pengaturan utama jalur tersebut.
Degradasi
Histidin, prolin, glutamat, arginin dan glutamin adalah asam amino yang, ketika terdegradasi, akhirnya membentuk -ketoglutarat. Empat di antaranya pertama-tama diubah menjadi glutamat, yang melalui transaminasi menghasilkan -ketoglutarat.
Histidin, melalui histidinase, kehilangan gugus -amino menjadi urokanat. Kemudian, urocanase menghidrasi posisi 1 dan 4 dari urokanat, membentuk 4-imidazolon-5-propionat. Selanjutnya, hidrolisis gugus imino dari 4-imidazolon-5-propionat terjadi, membentuk N-formiminoglutamat.
Reaksi terakhir melibatkan transfer formil dari N-formiminoglutamate ke tetrahydrofolate, yang bekerja dengan enzim glutamat formimino transferase. Produk akhir dari reaksi ini adalah glutamat dan N5-formimino tetrahydrofolate.
-ketoglutarat dibentuk oleh transaminasi glutamat. -Ketoglutarat adalah perantara dalam siklus Krebs dan juga dapat memasuki jalur glukoneogenik untuk pembentukan glukosa.
Gugus amino glutamat memasuki siklus produksi urea untuk dieliminasi dalam urin. Semua reaksi ini terjadi di hati dan beberapa di antaranya di kulit.
Makanan kaya histidin
Kebutuhan harian histidin adalah sekitar 10 sampai 11 mg per kg berat badan , per hari. Pada anak-anak yang sedang tumbuh, histidin adalah asam amino esensial yang harus dipasok melalui makanan.
Pada hewan lain, histidin juga merupakan asam amino esensial dan mereka yang dibesarkan di kandang harus menerima histidin untuk mempertahankan kadar hemoglobin normal.
Makanan yang kaya histidin meliputi:
– Daging sapi, domba, babi, ayam, dan kalkun. Ini juga ditemukan pada ikan seperti tuna (bahkan kalengan), salmon, trout, kakap, dan bass laut, serta beberapa kerang.
– Susu dan turunannya, terutama pada keju yang sudah matang seperti Parmesan, Gruyere, keju Swiss, gouda, dan lain-lain. Dalam krim, whey, yogurt dan krim asam.
– Kedelai dan buah-buahan kering seperti kenari dan biji-bijian. Dalam bunga matahari, labu, semangka, wijen, almond, pistachio, selai kacang dan biji chia.
– Telur dan kacang-kacangan atau kacang putih.
– Biji-bijian utuh seperti quinoa, gandum, beras merah, dll.
Manfaat asupannya
Ada sejumlah kondisi patologis di mana histidin dapat berguna sebagai tambahan untuk pengobatan.
Di antara patologi ini kita dapat menyebutkan rheumatoid arthritis, hipertensi arteri (karena efek hipotensi histidin telah dijelaskan), pada infeksi, frigiditas dan impotensi seksual, keracunan logam berat, sinovitis toksik, neuritis, muntah kehamilan, gangguan kardiovaskular dan pendengaran, bisul. dan anemia.
Di kulit, degradasi histidin yang dikonsumsi menghasilkan asam urokanat, yang mampu melindungi kulit dengan menyerap sinar ultraviolet.
Konsumsi histidin yang berlebihan oleh individu yang sehat tidak menghasilkan perubahan besar, karena histidin cepat terdegradasi. Namun, penggunaan suplemen makanan histidin harus dibatasi pada pasien dengan masalah hati dan / atau ginjal yang parah.
Gangguan kekurangan
Defisiensi histidin berhubungan dengan perubahan respon imun akibat penurunan produksi histamin dan sel darah putih, akumulasi radikal bebas, dan malformasi atau dwarfisme pada janin.
Masalah tulang, tuli dan anemia yang berhubungan dengan defisiensi histidin juga telah dilaporkan.
Penyakit Hartnup adalah kondisi bawaan yang mempengaruhi pengangkutan histidin dan triptofan melalui mukosa usus kecil dan ginjal , menyebabkan kekurangan kedua asam amino.
Manifestasi klinis yang paling relevan adalah munculnya lesi bersisik dan merah pada kulit setelah terpapar sinar matahari , berbagai tingkat gangguan gerakan dan beberapa gejala penyakit kejiwaan.
Histidinemia adalah penyakit resesif autosomal yang ditandai dengan defisiensi enzim histidase, yang menyebabkan peningkatan kadar histidin dalam darah dan urin.
Akibatnya, pasien ini tidak dapat mendegradasi histidin menjadi asam urokanat di hati dan kulit. Penyakit ini disertai dengan keterbelakangan mental sedang, cacat bicara dan memori pendengaran tanpa tuli.
Pembatasan asupan histidin sebagai pengobatan belum efektif dalam menghasilkan perbaikan klinis dan berisiko menimbulkan gangguan pertumbuhan pada anak yang terkena penyakit ini.
Referensi
- Mathews, C., van Holde, K., & Ahern, K. (2000). Biokimia (edisi ke-3). San Fransisco, California: Pearson.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Biokimia Harper’s Illustrated (edisi ke-28). McGraw-Hill Medis.
- Nelson, DL, & Cox, MM (2009). Prinsip Biokimia Lehninger . Edisi Omega ( edisi ke-5). doi.org
- Pencharz, P., Farri, L., & Papageorgiou, A. (1983). Efek susu manusia dan susu formula rendah protein pada tingkat pergantian protein tubuh total dan ekskresi 3-metilhistidin urin pada bayi prematur. Ilmu Klinis , 64 , 611–616.
- Lagu, BC, Joo, N., Aldini, G., & Yeum, K. (2014). Fungsi biologis histidin-dipeptida dan sindrom metabolik. Penelitian dan Praktik Gizi , 8 (1), 3–10.

