gangliosida yang sphingolipids membran milik kelas glycosphingolipids asam. Mereka adalah salah satu glikolipid yang paling melimpah dan terlibat dalam pengaturan banyak sifat membran, serta protein yang terkait dengannya. Mereka terutama berlimpah di jaringan saraf.
Mereka dicirikan oleh adanya residu gula dengan gugus karboksil (asam sialic) dan bersama dengan sulfatida, yang mengandung gugus sulfat O – terkait dengan residu glukosa atau galaktosa. Mereka mewakili salah satu dari dua keluarga glikosfingolipid asam pada eukariota.
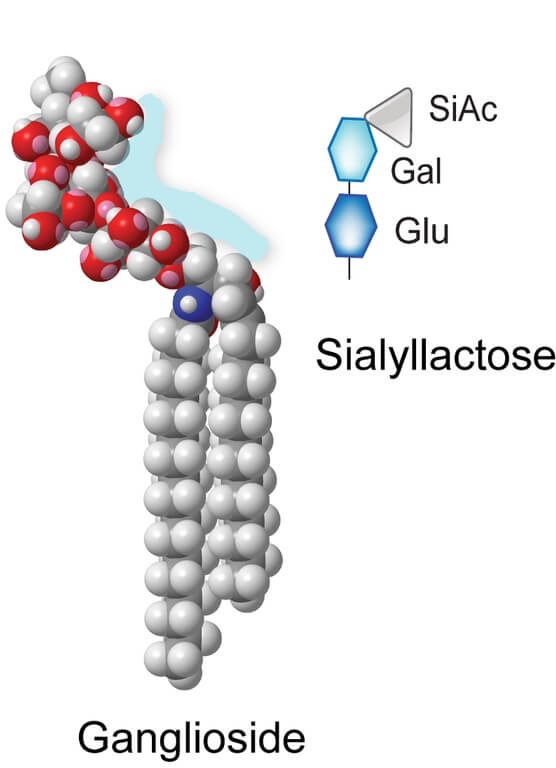
Contoh struktur gangliosida (Sumber: Caitlin Sedwick [CC BY 2.5 (https://creativecommons.org/licenses/by/2.5)], melalui Wikimedia Commons)
Istilah ganglioside diciptakan pada tahun 1939 oleh ahli biokimia Jerman Ernst Klenk, ketika ia merujuk pada campuran senyawa yang diekstraksi dari otak pasien dengan penyakit Niemann-Pick. Namun, struktur pertama gangliosida dijelaskan pada tahun 1963.
Mereka berbagi kerangka seramida hidrofobik dengan sphingolipid lainnya, yang terdiri dari molekul sphingosine yang dihubungkan oleh ikatan amida ke asam lemak antara 16 dan 20 atom karbon, dengan ikatan rangkap trans antara karbon di posisi 4. dan 5 .
Indeks artikel
Struktur
Gangliosida dicirikan dengan memiliki rantai oligosakarida pada kelompok kepala kutubnya, yang komposisinya terdapat molekul asam sialat yang dihubungkan oleh ikatan -glukosidik ke kerangka hidrofobik seramida.
Mereka adalah molekul yang sangat beragam mengingat beberapa kemungkinan kombinasi antara rantai oligosakarida, berbagai jenis asam sialat dan ekor apolar yang melekat pada kerangka seramida, baik dari sfingosin maupun asam lemak yang dihubungkan oleh ikatan amida ke kerangka tersebut.
Dalam jaringan saraf, rantai asam lemak yang paling umum di antara gangliosida diwakili oleh asam palmitat dan stearat.
Ciri-ciri gugus kutub
Daerah kepala kutub sphingolipids ini memberi mereka karakter hidrofilik yang kuat. Gugus polar ini sangat besar dibandingkan dengan fosfolipid seperti fosfatidilkolin, misalnya.
Alasan untuk sebagian besar ini berkaitan dengan ukuran rantai oligosakarida, serta jumlah molekul air yang terkait dengan karbohidrat ini.
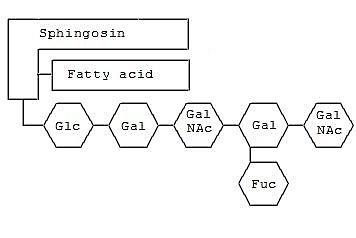
Struktur umum gangliosida (Sumber: Ryan_1991 [Domain publik], melalui Wikimedia Commons)
Asam silikat adalah turunan dari 5-amino-3,5-dideoksi-D- asam glisero -D- galacto -Non-2-ulopiranosoico atau asam neuroaminic. Ada tiga jenis asam sialat yang dikenal di gangliosida: 5- N- asetil, 5- N -asetil-9- O- asetil, dan 5- N -glikolil-turunan, yang paling umum pada manusia sehat.
Secara umum, mamalia (termasuk primata) mampu mensintesis asam 5- N -glikol-neuraminat, tetapi manusia harus mendapatkannya dari sumber makanan.
Klasifikasi lipid ini dapat didasarkan pada jumlah residu asam sialat (dari 1-5), dan pada posisinya dalam molekul glikosfingolipid.
Urutan oligosakarida yang paling umum adalah tetrasakarida Galβ1-3GalNAcβ1-4Galβ1-4Glcβ, tetapi residu yang lebih sedikit juga dapat ditemukan.
Fitur
Implikasi biologis yang tepat dari gangliosida belum sepenuhnya dijelaskan, bagaimanapun, mereka tampaknya terlibat dalam diferensiasi sel dan morfogenesis, dalam pengikatan beberapa virus dan bakteri, dan dalam proses adhesi sel tipe spesifik sebagai ligan untuk protein.
Dalam sistem saraf
Glikosfingolipid dengan asam sialat memiliki relevansi khusus dalam sistem saraf , terutama di sel materi abu – abu otak. Ini ada hubungannya dengan fakta bahwa glikokonjugat, secara umum, diakui sebagai informasi yang efisien dan kendaraan penyimpanan untuk sel.
Mereka sebagian besar terletak di monolayer luar membran plasma, oleh karena itu mereka memiliki partisipasi penting dalam glikokaliks, bersama dengan glikoprotein dan proteoglikan.
Glikokaliks atau matriks ekstraseluler ini penting untuk pergerakan sel dan aktivasi jalur pensinyalan yang terlibat dalam pertumbuhan, proliferasi, dan ekspresi gen.
Dalam pensinyalan sel
Seperti sphingolipid lainnya, produk sampingan dari degradasi gangliosida juga memiliki fungsi penting, terutama dalam proses sinyal dan daur ulang unsur untuk pembentukan molekul lipid baru.
Di dalam lapisan ganda, gangliosida terjadi sebagian besar di rakit lipid yang kaya sphingolipid, di mana “domain pensinyalan gliko” didirikan yang juga memediasi interaksi antar sel dan pensinyalan transmembran dengan stabilisasi dan asosiasi dengan protein integral. Rakit lipid ini melakukan fungsi penting dalam sistem kekebalan tubuh.
Dalam struktur
Mereka mempromosikan konformasi dan pelipatan yang benar dari protein membran penting, seperti ganglioside GM1 dalam mempertahankan struktur heliks protein -synuclein, yang bentuknya menyimpang dikaitkan dengan penyakit Parkinson. Mereka juga telah dikaitkan dengan patologi penyakit Huntington, Tay-Sachs dan Alzheimer.
Perpaduan
Biosintesis glikosfingolipid sangat bergantung pada transpor intraseluler melalui aliran vesikel dari retikulum endoplasma (RE), melalui aparatus Golgi dan berakhir di membran plasma.
Proses biosintetik dimulai dengan pembentukan kerangka ceramide pada permukaan sitoplasma RE. Pembentukan glikosfingolipid terjadi kemudian di aparatus Golgi.
Enzim glikosidase yang bertanggung jawab untuk proses ini (glukosiltransferase dan galaktosiltransferase) ditemukan di sisi sitosol kompleks Golgi.
Penambahan residu asam sialat ke rantai oligosakarida yang sedang tumbuh dikatalisis oleh beberapa glikosiltransferase yang terikat membran tetapi terbatas pada sisi luminal membran Golgi.
Garis bukti yang berbeda menunjukkan bahwa sintesis gangliosida paling sederhana terjadi di wilayah awal sistem membran Golgi, sedangkan yang paling kompleks terjadi di wilayah yang lebih “terlambat”.
Peraturan
Sintesis diatur dalam contoh pertama oleh ekspresi glikosiltransferase, tetapi peristiwa epigenetik seperti fosforilasi enzim yang terlibat dan lainnya mungkin juga terlibat.
Kegunaan
Beberapa peneliti telah memusatkan perhatian mereka pada kegunaan gangliosida tertentu, GM1. Toksin yang disintesis oleh V. cholera pada pasien kolera memiliki subunit yang bertanggung jawab atas pengenalan spesifik gangliosida ini, yang terdapat pada permukaan sel mukosa usus.
Dengan demikian, GM1 telah digunakan untuk mengenali penanda patologi ini karena termasuk dalam sintesis liposom yang digunakan untuk diagnosis kolera.
Kegunaan lain termasuk sintesis gangliosida spesifik dan pengikatannya pada penyangga stabil untuk tujuan diagnostik atau untuk pemurnian dan isolasi senyawa yang memiliki afinitas. Juga telah ditemukan bahwa mereka dapat berfungsi sebagai penanda untuk beberapa jenis kanker.
Referensi
- Groux-Degroote, S., Guérardel, Y., Julien, S., & Deannoy, P. (2015). Gangliosida pada Kanker Payudara: Perspektif Baru. Biokimia (Moskow) , 80 (7), 808-819.
- Ho, JA, Wu, L., Huang, M., Lin, Y., Baeumner, AJ, Durst, RA, & York, N. (2007). Kegunaan Liposom Tersensitisasi Gangliosida dalam Sistem Imunoanalisis Aliran Injeksi untuk Penentuan Toksin Kolera. anal Kimia , 79 (1), 10795-10799.
- Kanfer, J., & Hakomori, S. (1983). Biokimia Sphingolipid . (D. Hanahan, Ed.), Buku Pegangan Penelitian Lipid 3 (Edisi ke-1). Pers Pleno.
- Lodish, H., Berk, A., Kaiser, CA, Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Biologi Sel Molekuler (edisi ke-5). Freeman, WH & Perusahaan.
- O’Brien, J. (1981). Penyakit penyimpanan gangliosida: ulasan yang diperbarui. Italia. J. Neurol. Sci. , 3 , 219-226.
- Sonnino, S. (2018). Gangliosida. Dalam S. Sonnino & A. Prinetti (Eds.), Metode dalam Biologi Molekuler 1804 . Pers Manusia.
- Tayot, J.-L. (1983). 244.312 . Amerika Serikat.
- van Echten, G., & Sandhoff, K. (1993). Metabolisme Gangliosida. Jurnal Kimia Biologi , 268 (8), 5341-5344.

