fibronektin adalah sejenis glikoprotein yang dimiliki oleh matriks ekstraselular. Jenis protein ini pada umumnya bertanggung jawab untuk melekatkan atau mengikat membran sel dengan serat kolagen yang terdapat di bagian luar.
Nama “fibronektin” berasal dari kata yang terdiri dari dua kata Latin, yang pertama adalah ” serat” yang berarti serat atau filamen dan yang kedua adalah “necter” yang berarti menghubungkan, menghubungkan, merekatkan atau mengikat.
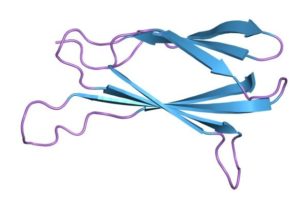
Struktur molekul fibronektin (Sumber: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik] melalui Wikimedia Commons)
Fibronektin pertama kali divisualisasikan pada tahun 1948 sebagai kontaminan fibrinogen disiapkan oleh proses fraksinasi etanol dingin Cohn. Ini diidentifikasi sebagai glikoprotein plasma unik yang memiliki karakteristik globulin tidak larut dingin.
Protein ini memiliki berat molekul tinggi dan telah dikaitkan dengan berbagai macam fungsi di dalam jaringan. Diantaranya adalah adhesi sel-sel, organisasi sitoskeleton, transformasi onkogenik, antara lain.
Fibronektin didistribusikan ke banyak tempat di tubuh melalui bentuknya yang larut dalam plasma darah, cairan serebrospinal , cairan sinovial, cairan ketuban, cairan mani, air liur, dan eksudat inflamasi.
Para peneliti telah melaporkan bahwa konsentrasi fibronektin plasma meningkat ketika wanita hamil menderita preeklamsia. Dengan demikian, peningkatan konsentrasi fibronektin ini telah dimasukkan oleh spesialis untuk mendiagnosis kondisi ini pada pasien.
Indeks artikel
Struktur
Fibronektin adalah glikoprotein besar, yang memiliki berat molekul sekitar 440 kDa. Mereka terdiri dari sekitar 2.300 asam amino, yang mewakili 95% dari protein, karena 5% lainnya adalah karbohidrat.
Analisis berbeda yang telah dilakukan pada sekuens genomik dan transkriptomik (messenger RNA) protein telah menunjukkan bahwa protein tersebut terdiri dari tiga blok sekuens homolog berulang, dengan panjang masing-masing 45, 60 dan 90 asam amino.
Tiga jenis urutan terdiri lebih dari 90% dari total struktur fibronektin. Urutan homolog tipe I dan II adalah loop yang dihubungkan satu sama lain oleh jembatan disulfida. Loop ini masing-masing mengandung 45 dan 60 residu asam amino.
Urutan homolog tipe III sesuai dengan 90 asam amino yang disusun secara linier dan tanpa jembatan disulfida di dalamnya. Namun, beberapa asam amino internal sekuens tipe III homolog memiliki gugus sulfhidrat bebas (RSH).
Tiga urutan homolog melipat dan mengatur dalam matriks yang kurang lebih linier untuk membentuk dua “lengan dimer” dari subunit protein yang hampir identik. Perbedaan antara dua subunit muncul dari peristiwa pematangan pasca-transkripsi.
Fibronektin dapat dilihat secara umum dalam dua cara. Suatu bentuk terbuka yang diamati ketika mereka disimpan pada permukaan membran dan siap untuk mengikat dengan beberapa komponen lain dari luar sel. Bentuk ini hanya terlihat dengan mikroskop elektron.
Bentuk lain dapat dilihat pada larutan fisiologis. Ujung setiap lengan atau ekstensi dilipat ke arah pusat protein, bergabung melalui ujung karboksil dari tempat pengikatan kolagen. Dalam bentuk ini protein memiliki penampilan globular.
Domain dan properti “multi-adhesi”
Sifat multi-adhesi fibronektin berasal dari adanya domain berbeda yang memiliki nilai afinitas tinggi untuk substrat dan protein yang berbeda.
“Lengan dimer” dapat dibagi menjadi 7 domain fungsional yang berbeda. Ini diklasifikasikan menurut substrat atau domain yang masing-masing mengikat. Misalnya: Domain 1 dan Domain 8 adalah domain pengikat protein fibrin.
Domain 2 memiliki sifat pengikatan kolagen, domain 6 adalah daerah adhesi sel, yaitu memungkinkannya untuk berlabuh di hampir semua membran atau permukaan luar sel. Fungsi domain 3 dan 5 masih belum diketahui hingga saat ini.
Di domain 9 ujung karboksil atau ujung terminal-C dari protein berada. Daerah adhesi sel domain 6 memiliki tripeptida yang terdiri dari urutan asam amino Arginine-Glycine-Asparagine (Arg-Gly-Asp).
Tripeptida ini digunakan bersama oleh beberapa protein seperti kolagen dan integrin. Ini adalah struktur minimum yang diperlukan untuk pengenalan membran plasma oleh fibronektin dan integrin.
Fibronektin, ketika dalam bentuk globular, mewakili bentuk yang larut dan bebas dalam darah. Namun, pada permukaan sel dan matriks ekstraseluler ditemukan dalam bentuk “terbuka”, kaku dan tidak larut.
Fitur
Beberapa proses di mana partisipasi fibronektin menonjol adalah perlekatan sel ke sel, perlekatan sel, koneksi, atau perlekatan pada plasma atau membran basal, stabilisasi bekuan darah, dan penyembuhan luka.
Sel-sel menempel pada tempat spesifik pada fibronektin melalui protein reseptor yang dikenal sebagai “integrin”. Protein ini melintasi membran plasma ke bagian dalam sel.
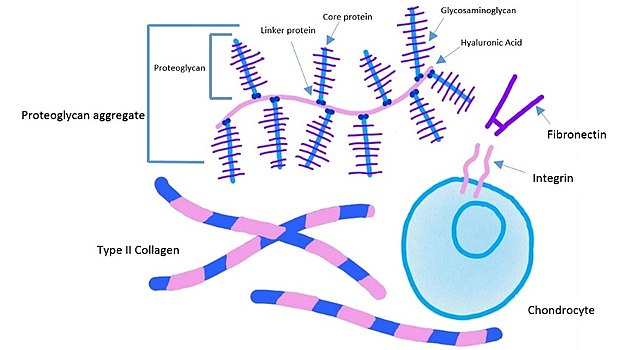
Komponen matriks ekstraseluler jaringan tulang rawan (Sumber: Kassidy Veasaw [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)] melalui Wikimedia Commons)
Domain ekstraseluler integrin berikatan dengan fibronektin, sedangkan domain intraseluler integrin melekat pada filamen aktin. Jenis penahan ini memungkinkannya untuk mengirimkan ketegangan yang dihasilkan dalam matriks ekstraseluler ke sitoskeleton sel.
Fibronektin berpartisipasi dalam proses penyembuhan luka. Ini, dalam bentuk larutnya, disimpan pada serat kolagen yang berdekatan dengan luka, membantu migrasi fagosit, fibroblas, dan proliferasi sel pada luka terbuka.
Proses penyembuhan yang sebenarnya dimulai ketika fibroblas “memutar” jaringan fibronektin. Jaringan ini bertindak sebagai semacam perancah atau dukungan untuk deposit serat kolagen baru, heparan sulfat, proteoglikan, kondrotin sultafo dan komponen lain dari matriks ekstraseluler yang diperlukan untuk memperbaiki jaringan.
Fibronektin juga terlibat dalam pergerakan sel-sel epidermis, karena melalui jaringan granular membantu mengatur ulang membran basal di bawah epidermis di jaringan, yang membantu terjadinya keratinisasi.
Semua fibronektin memiliki fungsi penting untuk semua sel; mereka berpartisipasi dalam proses yang beragam seperti migrasi dan diferensiasi sel, homeostasis, penyembuhan luka, fagositosis, antara lain.
Referensi
- Conde-Agudelo, A., Romero, R., & Roberts, JM (2015). Tes untuk memprediksi preeklamsia. Pada gangguan hipertensi Chesley dalam kehamilan (hal. 221-251). Pers Akademik.
- Farfan, J. . L., Tovar, HBS, de Anda, MDRG, & Guevara, CG (2011). Fibronektin janin dan panjang serviks sebagai prediktor awal persalinan prematur. Ginekologi dan Obstetri Meksiko, 79 (06), 337-343.
- Feist, E., & Hiepe, F. (2014). autoantibodi fibronektin. Dalam Autoantibodi (hlm. 327-331). lain.
- Letourneau, P. (2009). Pathfinding aksonal: Peran matriks ekstraseluler. Ensiklopedia ilmu saraf, 1, 1139-1145.
- Pankov, R., & Yamada, KM (2002). Sekilas tentang Fibronektin. Jurnal ilmu sel, 115 (20), 3861-3863.
- Proctor, RA (1987). Fibronektin: gambaran singkat tentang struktur, fungsi, dan fisiologinya. Ulasan penyakit menular, 9 (Tambahan_4), S317-S321.

