alpha amilase (α-amilase) adalah kelompok enzim amilolitik amilase Endo yang bertanggung jawab untuk hidrolisis α-1,4 ikatan antara residu glukosa yang terdiri berbagai jenis karbohidrat di alam.
Secara sistematis dikenal dengan nama -1,4-glucan 4-glucanohydroles memiliki sebaran yang luas, karena terdapat pada hewan, tumbuhan dan mikroorganisme. Pada manusia, misalnya, amilase yang ada dalam air liur dan yang disekresikan oleh pankreas adalah dari jenis -amilase.
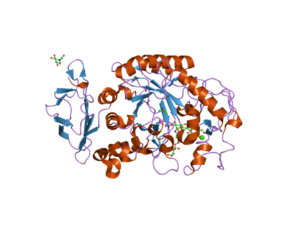
Struktur domain terminal-C dari enzim alfa amilase hewan (Sumber: Jawahar Swaminathan dan staf MSD di European Bioinformatics Institute [Domain publik] melalui Wikimedia Commons)
Kuhn, pada tahun 1925, adalah orang pertama yang menciptakan istilah “α-amilase” berdasarkan fakta bahwa produk hidrolisis yang mengkatalisis enzim ini memiliki konfigurasi . Kemudian, pada tahun 1968 ditentukan bahwa tindakan ini lebih disukai pada substrat konfigurasi struktural linier dan tidak bercabang.
Seperti enzim amilolitik lainnya, -amilase bertanggung jawab untuk hidrolisis pati dan molekul terkait lainnya seperti glikogen, menghasilkan polimer yang lebih kecil yang terdiri dari unit glukosa berulang.
Selain fungsi fisiologis yang dimiliki enzim ini pada hewan, tumbuhan dan mikroorganisme yang mengekspresikannya, -amilase, bersama dengan kelas amilase lain yang ada, mewakili 25% dari enzim yang digunakan untuk keperluan industri dan bioteknologi di pasar saat ini. .
Banyak spesies jamur dan bakteri merupakan sumber utama untuk memperoleh -amilase yang paling sering digunakan dalam industri dan eksperimen ilmiah. Ini terutama karena keserbagunaannya, mudah diperoleh, penanganannya sederhana, dan biaya produksinya rendah.
Indeks artikel
Karakteristik
-amilase yang ditemukan di alam dapat memiliki rentang pH optimal yang sangat berbeda untuk fungsinya; misalnya, optimum untuk -amilase hewan dan tumbuhan adalah antara 5,5 dan 8,0 unit pH, tetapi beberapa bakteri dan jamur memiliki enzim yang lebih basa dan lebih asam.
Enzim yang ada dalam air liur dan pankreas mamalia bekerja paling baik pada pH mendekati 7 (netral), selain itu, mereka membutuhkan ion klorida untuk mencapai aktivitas enzimatik maksimumnya dan mampu mengikat ion kalsium divalen.
Baik enzim hewan, saliva dan pankreas, diproduksi dalam organisme melalui mekanisme independen yang melibatkan sel dan kelenjar tertentu dan yang mungkin tidak terkait dengan enzim yang ada dalam aliran darah dan rongga tubuh lainnya.
Baik pH dan suhu optimal untuk berfungsinya enzim-enzim ini sangat bergantung pada fisiologi organisme yang dipertimbangkan, karena ada mikroorganisme ekstremofilik yang tumbuh dalam kondisi yang sangat khusus sehubungan dengan ini dan banyak parameter lainnya.
Akhirnya, dalam hal pengaturan aktivitasnya, karakteristik yang dimiliki bersama di antara enzim dari kelompok -amilase adalah bahwa ini, seperti amilase lainnya, dapat dihambat oleh ion logam berat seperti merkuri, tembaga, perak dan timbal.
Struktur
-amilase adalah enzim multidomain yang, pada hewan dan tumbuhan, memiliki berat molekul perkiraan 50 kDa dan penulis yang berbeda setuju bahwa enzim milik keluarga glikohidrolase adalah enzim dengan lebih dari sepuluh domain struktural.
Domain pusat atau domain katalitik sangat terkonservasi dan dikenal sebagai domain A, yang terdiri dari lipatan simetris dari 8 lembar lipat yang disusun dalam bentuk “barrel” yang dikelilingi oleh 8 heliks alfa, sehingga dapat juga ditemukan di yang sastra sebagai (β / α) 8 atau barel jenis “TIM”.
Penting untuk dicatat bahwa pada ujung terminal-C dari lembar- domain A adalah residu asam amino yang terlibat dalam katalisis dan pengikatan substrat, dan bahwa domain ini terletak di wilayah terminal-N protein. .
Domain lain yang paling banyak dipelajari dari enzim-enzim ini adalah apa yang disebut domain B, yang menonjol di antara lembaran lipatan dan heliks alfa nomor 3 dari domain A. Ini memainkan peran mendasar dalam pengikatan substrat dan kalsium divalen. .
Domain tambahan telah dijelaskan untuk enzim -amilase, seperti domain C, D, F, G, H dan I, yang terletak di depan atau di belakang domain A dan yang fungsinya tidak diketahui secara pasti dan bergantung pada organisme yang bersangkutan. dipelajari.
-amilase mikroorganisme
Berat molekul -amilase tergantung, serta karakteristik biokimia dan struktural lainnya, dari organisme yang dipelajari. Dengan demikian, -amilase dari banyak jamur dan bakteri memiliki bobot serendah 10 kDa dan setinggi 210 kDa.
Berat molekul tinggi dari beberapa enzim mikroba ini sering dikaitkan dengan adanya glikosilasi, meskipun glikosilasi protein pada bakteri cukup jarang.
Fitur
Pada hewan, -amilase bertanggung jawab untuk langkah pertama dalam metabolisme pati dan glikogen, karena mereka bertanggung jawab untuk hidrolisis mereka menjadi fragmen yang lebih kecil. Organ sistem pencernaan yang bertanggung jawab untuk produksinya pada mamalia adalah pankreas dan kelenjar ludah.
Selain fungsi metaboliknya yang jelas, produksi -amilase yang diproduksi oleh kelenjar ludah banyak mamalia, yang diaktifkan oleh aksi norepinefrin, dianggap oleh banyak penulis sebagai penanda stres “psikobiologis” yang penting di sistem saraf pusat .
Ini juga memiliki fungsi sekunder dalam kesehatan mulut, karena aktivitasnya bekerja untuk menghilangkan bakteri mulut dan mencegah mereka menempel pada permukaan mulut.
Fungsi utama pada tumbuhan
Pada tumbuhan, -amilase memainkan peran penting dalam perkecambahan biji, karena mereka adalah enzim yang menghidrolisis pati hadir dalam endosperma yang memelihara embrio di dalam, sebuah proses dasarnya dikendalikan oleh giberelin, fitohormon.
Kegunaan industri
Enzim milik keluarga -amilase memiliki banyak aplikasi dalam banyak konteks yang berbeda: industri, ilmiah dan bioteknologi, dll.
Dalam industri pengolahan pati besar, -amilase populer digunakan untuk produksi glukosa dan fruktosa, serta untuk produksi roti dengan tekstur yang lebih baik dan daya angkat yang lebih tinggi.
Di bidang bioteknologi, ada banyak minat mengenai peningkatan enzim yang digunakan secara komersial, untuk meningkatkan stabilitas dan kinerjanya dalam kondisi yang berbeda.
Referensi
- Aiyer, PV (2005). Amilase dan Kegunaannya Jurnal Bioteknologi Afrika , 4 (13), 1525–1529.
- Bernfeld, P. (1960). Amilase, a dan B. Dalam Enzim Metabolisme Karbohidrat (Vol. I, pp. 149-158).
- Granger, DA, Kivlighan, KT, El, M., Gordis, EB, & Stroud, LR (2007). Air liur a-Amylase dalam Penelitian Biobehavioral. Perkembangan dan Kegunaan Terbaru. Ann. NY Acad. Sci. , 1098 , 122-144.
- Monteiro, P., & Oliveira, P. (2010). Penerapan Mikroba a-Amylase dalam Industri- Sebuah tinjauan. Jurnal Mikrobiologi Brasil , 41 , 850–861.
- Reddy, NS, Nimmagadda, A., & Rao, KRSS (2003). Gambaran umum dari keluarga -amilase mikroba. Jurnal Bioteknologi Afrika , 2 (12), 645–648.
- Garam, W., & Schenker, S. (1976). Amilase- Signifikansi klinisnya: Tinjauan Literatur. Kedokteran , 55 (4), 269–289.
- Svensson, B., & Macgregor, EA (2001). Hubungan urutan dan struktur dengan spesifisitas dalam keluarga enzim a-amilase. Biochimica et Biophysica Acta , 1546 , 1–20.
- Thoma, JA, Spradlin, JE, & Dygert, S. (1925). Amilase Tumbuhan dan Hewan. Ann. Kimia. , 1 , 115-189.

